
题目列表(包括答案和解析)
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。

(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为 。
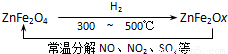
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
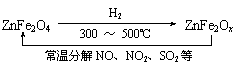
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x= 。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)

 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和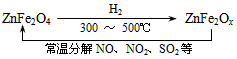
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com