
题目列表(包括答案和解析)
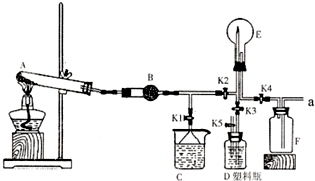 如图是实验室中某种气体的制备、性质检验及收集装置图.
如图是实验室中某种气体的制备、性质检验及收集装置图.
| ||
| ||
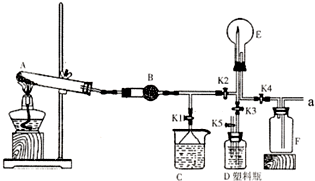 如图是实验室中某种气体的制备、性质检验及收集装置图.
如图是实验室中某种气体的制备、性质检验及收集装置图.实验室中盐酸的用途十分广泛,常常用来制备气体。
(1)某小组同学欲用4 mol/L的盐酸配制230 mL 0.4mol/L 盐酸溶液,需取用4 mol/L盐酸 mL,实验中需要用到的玻璃仪器有 、 、量筒、 烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)(16分)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。( 3Cl2+6KOH ![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
 |
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式 。
(2) 反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
(4)请在装置图方框中画出缺少的实验装置,并注明试剂。

 2NH3,5min后达到平衡,平衡时氨的体积分数为25%.
2NH3,5min后达到平衡,平衡时氨的体积分数为25%.实验室提供下列药品:①蒸馏水;②用HNO3酸化的AgNO3溶液;③熟石灰;④淀粉;⑤肥皂水;⑥食醋;⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等糊状物);⑧NaCl;⑨纯碱,某同学准备进行下列小实验:
A.制NaOH溶液
B.制备Cl2并验证其漂白性
C.制CO2气体
(1)由于缺少试剂而不能进行的实验是(不考虑电解)________(填代号).
(2)该同学为制备NH3,先从废干电池中制备NH4Cl.为此,他设想将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发灼烧滤液,以制得干燥的NH4Cl晶体.他的设想是否合理?答:________,理由是________________.
(3)另有同学设计了实验室制取CO2的如图四种实验原理和装置;

你认为其中不合理的是________;理由是________________.
(4)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重新提供足量的浓氨水、碱石灰,请设计一个最简单的实验,以快速制得NH3.
你的设计方案是________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com