
题目列表(包括答案和解析)
石油裂化的主要目的是为了
A.提高轻质液体燃料的产量
B.便于分馏
C.获得短链不饱和气态烃
D.提高汽油的质量
【化学——选修:化学与技术】 ( 15分)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
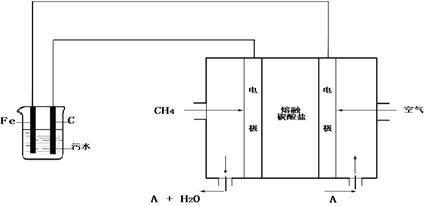
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 ;
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.C H3CH2OH
(2)电解池阳极的电极反应分别是:① ;
②4OH-- 4 e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 ;
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,
稀土金属材料为电极。已知负极的电极反应是CH4+4CO32-- 8e-=5CO2+2H2O。
①正极的电极反应是 ;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 ;
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4
(标准状况) L。
2- 4 |

某省2007年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9 %,阳离子以铵根离子为主,约占阳离子总量的84.1 %。阴离子中![]() 和
和![]() 的质量比为4.13∶1,
的质量比为4.13∶1,![]() 的比例呈明显上升的趋势。
的比例呈明显上升的趋势。
回答下列问题:
(1)该省大气污染特征是_________
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)请你提出该省防治酸雨的两条主要措施_________________________;
(3)某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①参加该课题的探究,在小组讨论测定地点时,选择的测定地点分别是工厂、学校、村庄(或居民住宅区)、公园(或农田)等。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262—94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是_______________________。③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:

该反应类型属于______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com