
题目列表(包括答案和解析)
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:
I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨()溶液,以获得纯净原料气。其中,吸收CO的反应为:
(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将氧化为
,则反应中还原剂与氧化剂的物质的量之比是____________;
III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:
I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨( )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为:
(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将 氧化为
氧化为 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;
III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:

I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨( )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为:

(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将 氧化为
氧化为 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;

III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
(16分)、据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:

 已知: 一定条件(Ⅰ)RNH2+
已知: 一定条件(Ⅰ)RNH2+ CH2Cl →
RNHCH2
CH2Cl →
RNHCH2 +HCl(R和
+HCl(R和 代表烃基);
代表烃基);
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ) (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)
(Ⅳ)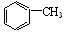 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
回答下列问题:
(1)C的结构简式是 。
(2)请写出D+E→F的化学方程式: 。
(3)E在一定条件下,可聚合成很好的功能高分子材料,写出合成此高聚物的化学方程式 。
(4)反应①~⑤中,属于取代反应的是(填反应序号)
(5)符合下列条件的E的同分异构体的数目是( )。
①与FeCl3溶液有显色反应 ②能发生银镜反应 ③苯环上的一溴取代物只有3种。
A、3种 B、8种 C、10种 D、12种
(6) 已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),反应方程式如下:
C6H5CHO + (CH3CO)2O → C6H5CH=CHCOOH +CH3COOH
苯甲醛 肉桂酸
若苯甲醛的苯环上有取代基,也能发生Perkin反应,相应产物的产率如下:
|
反应物
|
|
|
|
|
|
产率(%) |
15 |
23 |
33 |
0 |
|
反应物
|
|
|
|
|
|
产率(%) |
71 |
63 |
52 |
82 |
请根据上表回答:取代基对Perkin反应的影响有(写出3条即可):
①
②
③ [来
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。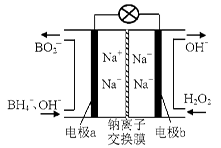
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。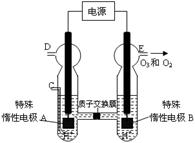
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx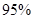 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) 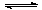 NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 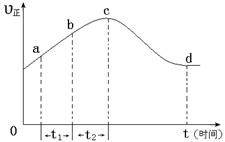
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com