[有机化学基础]2006年5月14日某新闻媒体报道齐齐哈尔第二制药有限公司生产的假药事件,“齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C
3H
8O
2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡.二甘醇又称乙二醇醚,分子式为C
4H
10O
3(HO-CH
2-CH
2-O-CH
2-CH
2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷
删除此空
删除此空
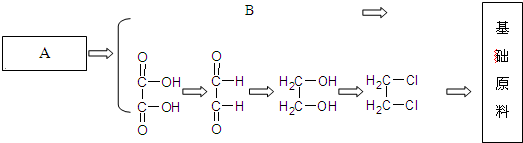
等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为
裂解
裂解
.
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是
氢氧化钠水溶液、加热
氢氧化钠水溶液、加热
,该反应属于
取代反应
取代反应
(添反应类型).写出B可能生成E的化学方程式:
CH
2BrCH
2Br+2NaOH
HC≡CH↑+2NaBr
CH
2BrCH
2Br+2NaOH
HC≡CH↑+2NaBr
.
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A:
C2H2
C2H2
B:
BrCH2CH2Br
BrCH2CH2Br
C:
HOCH2CH2OH
HOCH2CH2OH
(5)反应Ⅲ的化学方程式为:
2HO-CH
2-CH
2-OH
2HO-CH
2-CH
2-O-CH
2-CH
2-OH+H
2O
2HO-CH
2-CH
2-OH
2HO-CH
2-CH
2-O-CH
2-CH
2-OH+H
2O
.
(6)写出二甘醇制备1,4-二恶烷的化学方程式:
HO-CH
2-CH
2-O-CH
2-CH
2-OH

+H
2O
HO-CH
2-CH
2-O-CH
2-CH
2-OH

+H
2O
.


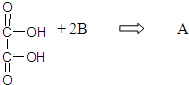

 +H2O
+H2O +H2O
+H2O