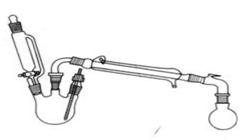
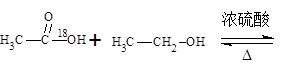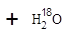实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 产率 65%
1 : 10 97%
(在120 ℃下测定)

已知:相关物理性质(常温常压)
| 密度g/mL
| 熔点/℃
| 沸点/℃
| 水溶性
|
乙醇
| 0.79
| -114
| 78
| 溶
|
乙酸
| 1.049
| 16.2
| ~117
| 溶
|
乙酸乙酯
| 0.902
| ?84
| ~76.5
| 不溶
|
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na
2CO
3溶液、饱和NaCl溶液、饱和CaCl
2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
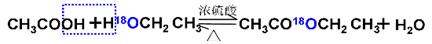
(1)酯化反应的机制
用乙醇羟基氧示踪

用醋酸羟基氧示踪



含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机制
。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=
。
为了使正反应有利,通常采用的手段是:
①使原料之一过量。谁过量 ?
无水乙醇3600元/吨,冰醋酸2900元/吨。每摩乙醇
元,每摩冰醋酸
元。
②不断移走产物[例如除水,乙酸乙酯、乙醇、水可形成三元恒沸物(沸点:70.2 ℃),乙酸不能形成三元恒沸物]。综上所述选择
过量。
(3)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合?
。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?
。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?
。
饱和的Na
2CO
3溶液洗涤除去乙酸。如何判断是否除净?
。
用饱和NaCl溶液洗涤除去残留的Na
2CO
3溶液,为什么不用水?
。
用饱和CaCl
2溶液直接洗涤起什么作用:
。

 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O 





 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O