下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
| a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| b |
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
e |
f |
|
| g |
h |
|
|
|
|
|
|
|
|
|
|
i |
j |
|
k |
l |
m |
| n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|

试回答下列问题:
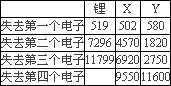
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
Si
Si
(填元素符号);
(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:
因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.
(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
CO2
CO2
,该分子是由
极性
极性
键构成的
非极性
非极性
分子(填“极性”或“非极性”);元素d的氧化物的分子式是
N2O
N2O
.
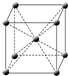
(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
12
12
,一个晶胞中i原子的数目为
4
4
;晶胞中存在两种空隙,分别是
正四面体空隙
正四面体空隙
、
正八面体空隙
正八面体空隙
.







 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
