
题目列表(包括答案和解析)
某校化学兴趣小组设计以下装置进行不同的实验其中a为用于鼓入空气的气囊,b为螺旋状铜丝,C为NaOH溶液,d为冰水混合物。
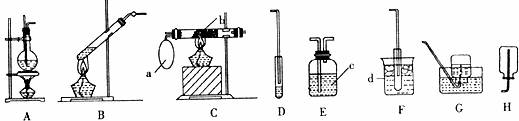
Ⅰ.制取并收集乙烯气体:该反应的化学方程式是 ,实验过程中发现反应混合物变黑,据此推测生成的乙烯中可能含有的具有刺激性气味的气体杂质是 ,该实验选用的装置是 (填装置编号)。
Ⅱ.乙酸乙酯的制取:、该反应的化学方程式是 ;该实验选用的装置有 (填装置编号)。实验开始时,向反应装置中添加试剂的顺序为 ,向接收装置中加入的试剂是 ;实验过程中,为加快酯化反应的速率,通常采用的措施是 ;实验结束时,为得到乙酸乙酯而进行的分离操作是 (写出操作名称)。
Ⅲ. 乙醇的催化氧化实验:反应的化学方程式是 , 选用的装置是 (填装置编号)。
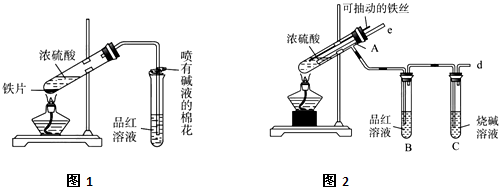
 某校化学兴趣小组在实验里制取乙烯时,加热时,因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气和炭黑.
某校化学兴趣小组在实验里制取乙烯时,加热时,因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气和炭黑.
| ||
| ||
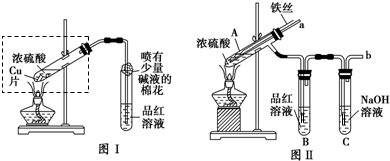
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
| C | 浓H2SO4和乙醇 | 反应器(或发生气体) |
B B |
无水CuSO4 无水CuSO4 |
检验H2O 检验H2O |
A A |
品红溶液 品红溶液 |
检验SO2 检验SO2 |
A A |
酸性KMnO4溶液 酸性KMnO4溶液 |
吸收余下的SO2 吸收余下的SO2 |
A A |
澄清石灰水 澄清石灰水 |
检验CO2的存在 检验CO2的存在 |
| ||

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
| 步骤 | 所选试剂 | 现象及结论 |
| 1 | ||
| 2 | ||
| 3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com