
题目列表(包括答案和解析)
当电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子数占原来总分子数的百分数叫做该电解质的电离度。现欲粗略测定一未知浓度的CH3COOH溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是( )
A.电解、NaOH溶液 B.中和滴定(以酚酞为指示剂)、pH试纸
C.酯化反应、石蕊溶液 D.蒸馏、Na2CO3溶液
A.已达电离平衡的溶液,其中的离子和分子的浓度保持不变
B.已达电离平衡的溶液,当升温时电离平衡会发生移动
C.在已达电离平衡的溶液里,既有部分弱电解质的分子电离出离子,又有离子结合成分子
D.在V mL 0.1 mol·L-1的醋酸溶液中,其H+浓度为a mol·L-1,若用水稀释到2 V mL,则H+浓度为![]() mol·L-1
mol·L-1
下列有关电离平衡的叙述中,错误的是( )
A.已达电离平衡的溶液,其中的离子和分子的浓度保持不变
B.已达电离平衡的溶液,当升温时电离平衡会发生移动
C.在已达电离平衡的溶液里,既有部分弱电解质的分子电离出离子,又有离子结合成分子
D.在V mL 0.1 mol·L-1的醋酸溶液中,其H+浓度为a mol·L-1,若用水稀释到2 V mL,则H+浓度为![]() mol·L-1
mol·L-1
| A.已达电离平衡的溶液,其中的离子和分子的浓度保持不变 |
| B.已达电离平衡的溶液,当升温时电离平衡会发生移动 |
| C.在已达电离平衡的溶液里,既有部分弱电解质的分子电离出离子,又有离子结合成分子 |
D.在V mL 0.1 mol·L-1的醋酸溶液中,其H+浓度为a mol·L-1,若用水稀释到2 V mL,则H+浓度为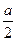 mol·L-1 mol·L-1 |
| 酸 | 点解方程式 | 电离平衡常数 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ |
K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| cα2 |
| 1-α |
| cα2 |
| 1-α |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com