
题目列表(包括答案和解析)
A.有酸性和氧化性,无还原性
B.有酸性、氧化性和还原性
C.有酸性、还原性,无氧化性
D.盐酸是非氧化性酸,在化学反应中不可能表现氧化性

| 空气 |
| △ |
| HNO3(稀) |
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
⑴稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为________________________________________________________。
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
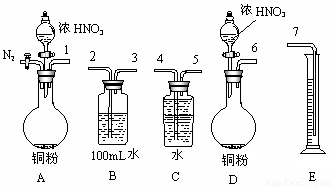
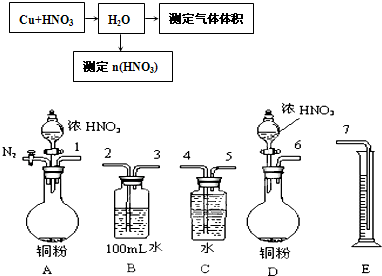
⑵某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
 |
①若要测定NO的体积,从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3 ,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为 L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com