
题目列表(包括答案和解析)
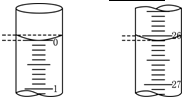 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 |
待测氢氧化钠溶液的体积/mL | 0.1000 mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |

| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | - |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
| ||
| ||
已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
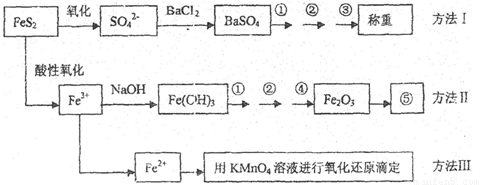
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A、砝码生锈 B、定容时俯视
C、称量时物质和砝码位置反了(需要游码) D、容量瓶用待装液润
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
孔雀石主要含Cu2(OH)2CO3,还含少量杂质FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有__________。检验溶液A中Fe3+的最佳试剂为
A、KMnO4 B、(NH4) 2S C、H2O2 D、KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。
(3)制备CaCO3时,应向CaCl2溶液中先加入NH3.H2O,然后通入CO2,反应的方程式:__________________________________________________________________。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(5)探究氧化铜的性质:取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com