
题目列表(包括答案和解析)

利用天然气合成氨的工艺流程示意图如下:
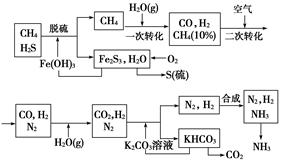
依据上述流程,完成下列填空:
(1)n mol CH4经一次转化后产生CO 0.9n mol,产生H2________mol(用含n的代数式表示)。
(2)K2CO3溶液和CO2反应在加压条件下进行,加压的理论依据是________(填字母代号)。
a.相似相溶原理 b.平衡移动原理 c.酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于________(写出CO2的一种重要用途)。
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3溶液循环,三是________循环。
利用天然气合成氨的工艺流程示意图如下:
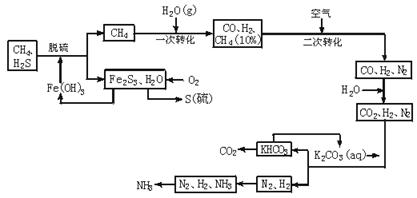
依据上述流程,完成下列填空:
(1)天然脱硫时的化学方程式是 。
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)。
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是________(多选扣分)。
(a)相似相溶原理 (b)勒夏特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于 (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
利用天然气合成氨的工艺流程示意图如下:
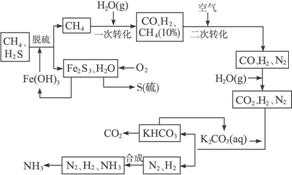
依据上述流程,完成下列填空。
(1)天然气脱硫时的化学方程式是________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2________mol。(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是__________。(多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于__________ (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
用天然气合成氨的工艺流程示意如下:

依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
一:1
B
二;
15. (10分)(1)(1分)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)(2分)容量瓶(100mL);玻璃棒
(3)(1分)①开始阶段醋酸溶液中的C(H+)远小于相同浓度的盐酸中的C(H+)
②(1分)t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
(1分)t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(4)(2分)①相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(5)(2分)CH3COONa固体、水或NaCl溶液
16.(8分)(1)铁 白磷 (2分,)
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2(2分) FeCl2(1分)
(3) (NH4)2SO4 (1分)
(4)PCl5(g)===Cl2(g)+PCl3(g);△H=+211.0kJ/mol。(2分,)
17(10分)(2分×5)(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
 (5)
(5)
18.(10分)(1)Fe3++3H2Dz Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
(3)Bi3+ Bi(HDz)3 (2分) ;3∶2 (1分);
(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
19. (12分)【假设与猜想】
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;(2分)
【实验准备】
问题1:(托盘)天平、烧杯、玻璃棒、量筒;(2分)
【实验现象】
问题2:0.8 1.0(4分)
问题3:温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。(2分)
问题4:勒沙特列原理(或化学平衡移动原理)。(2分)
20. (10分)(1)4.137 (2分) (2)0.056mol/L (2分) (3)0.006mol (2分)
(4)12 (4分)
21.(12分) (1)C、 Li+ 、 S2-
>F- > Mg2+(各1分,共3分);
、 S2-
>F- > Mg2+(各1分,共3分);
(2)分子晶体(1分),NCl3 + 3 H2O ==NH3 + 3HClO(2分);
(3)e (1分)
(4)铝镁合金(1分)。
(5) 金属(1分) 7s27p5 (1分)
(6)NH3、BF3或其它合理答案(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com