
题目列表(包括答案和解析)
据报道,最近某公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
(1)该电池反应的总离子方程式为____________________________
(2)甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变);
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为__________________________________。
②放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
 CO(g)+3H2(g) △H
CO(g)+3H2(g) △H  CH3OH(g) △H
CH3OH(g) △H 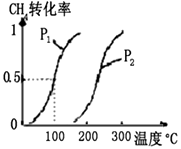

 2CO32-+ 6H2O,放电时负极的电极反应方程为_______________________
2CO32-+ 6H2O,放电时负极的电极反应方程为_______________________ 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com