某同学设计下图装置进行铁和浓H
2SO
4反应的实验探究,请回答下列问题.
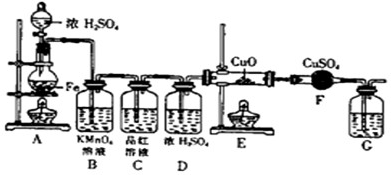
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H
2SO
4,结果没有任何反应现象,原因是
铁在冷的浓硫酸中钝化
铁在冷的浓硫酸中钝化
.随后点燃A处酒精灯,就有气体产生了.
(2)随着反应的进行,B中酸性KMnO
4溶液颜色逐渐变浅(产物中有Mn
2+),请用离子方程式表示:
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
,C中品红溶液颜色始终没有变化.
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
待反应产生的H2将装置中的空气排尽再加热,防止H2与空气混合加热爆炸
待反应产生的H2将装置中的空气排尽再加热,防止H2与空气混合加热爆炸
.
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象
白色粉末变为蓝色
白色粉末变为蓝色
.
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是
CD
CD
A.CaCl
2溶液 B.Ca(OH)
2溶液 C.浓硫酸 D.CCl
4(6)将a mol Fe与含b mol H
2SO
4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H
2SO
4均恰好完全反应,则生成的有
气体1是
H2
H2
,其物质的量为
(2a-b)
(2a-b)
mol,
气体2是
SO2
SO2
,其物质的量为
(b-a)
(b-a)
mol.

