
题目列表(包括答案和解析)
A.向容量瓶内注入液体时,玻璃棒与容量瓶瓶口紧密接触
B.检验溶液酸碱性时,用玻璃棒蘸取溶液滴到放在表面皿上的pH试纸中部
C.配制100mL 0.1 moL/L食盐溶液时,将称量的食盐放入烧杯中先加少量的水搅拌溶解
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释l00倍,pH都为5
D.两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小
Ⅰ(5分)⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为 ▲ mol/L。
⑵若从上述溶液中取出10 ml,则这10 ml 溶液的物质的量浓度为 ▲ mol/L,含溶质的质量为 ▲ g。
⑶若将上述10 ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为 ▲ mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ ml 。
Ⅱ(6分)现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸 ▲ ml。
需要使用的实验仪器有烧杯、 ▲ 、 ▲ 、 ▲ 、 ▲ ,
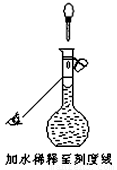
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲ (填“正确”、“偏大”或“偏小”)。
Ⅰ(5分)⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为 ▲ mol/L。
⑵若从上述溶液中取出10 ml,则这10ml 溶液的物质的量浓度为 ▲ mol/L,含溶质的质量为 ▲ g。
⑶若将上述10ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为 ▲ mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ ml 。
Ⅱ(6分)现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸 ▲ ml。
需要使用的实验仪器有烧杯、 ▲ 、 ▲ 、 ▲ 、 ▲ ,
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲ (填“正确”、“偏大”或“偏小”)。
Ⅰ(5分)⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为 ▲ mol/L。
⑵若从上述溶液中取出10 ml,则这10 ml 溶液的物质的量浓度为 ▲ mol/L,含溶质的质量为 ▲ g。
⑶若将上述10 ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为 ▲ mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ ml 。
Ⅱ(6分)现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸 ▲ ml。
需要使用的实验仪器有烧杯、 ▲ 、 ▲ 、 ▲ 、 ▲ ,
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲ (填“正确”、“偏大”或“偏小”)。
▲ (填“正确”、“偏大”或“偏小”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com