
题目列表(包括答案和解析)


 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。 
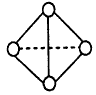
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
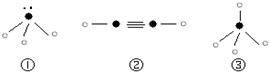
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.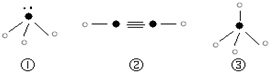
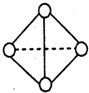
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |




| 氟化物 | AF | BF2 | DF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 1 |
| 2 |
| 3 |
| 2 |
(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,C ,E 。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出E2C的电子式: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。

① 阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④ 下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com