
题目列表(包括答案和解析)
①高温下用碳还原二氧化硅制得粗硅
![]()
③SiHCl3与过量H2在1 000—1
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请完成下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是_______________________。装置C中的烧瓶需要加热,其目的是___________________________________。
②反应一段时间后,装置D中观察到的现象是__________________________,装置D不能采用普通玻璃管的原因是___________________________________,装置D中发生反应的化学方程式为_______________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________。
| |||||||||||
| |||||||||||
晶体硅是一种重要的非金属材料.制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:________.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
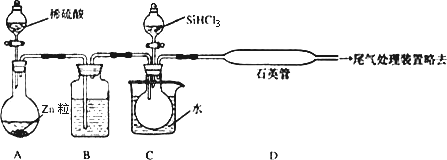
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是:________.
②装置D中发生反应的化学方程式为________,装置D不能采用普通玻璃管的原因是________.
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________.
④为鉴定产品硅中是否含微量铁单质,请设计实验进行检验,在答题卡相应位置叙述实验操作、预期现象和结论.
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:____________.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是______,装置C中的烧瓶需要加热,其目的是:______。
②装置D中发生反应的化学方程式为_____________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________________
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
一.单项选择
1.D 2.A 3.B 4.B 5.D 6.C 7.B 8.A
二.不定项选择
9.A 10.BC 11.AD 12.AC 13.CD 14.B 15.C 16.D
三.(本题包括2小题,共22分)
17.①③⑤⑦(6分) 说明:漏选、错选一个均扣2分,扣完为止
18.⑴分馏(或蒸馏)(2分)
⑵①浓硫酸(1分) 使滴入烧瓶中的SiHCl3气化(2分)
②有固体物质生成(1分) 在1000~1100℃的反应温度下,普通玻璃会软化(1分)
SiHCl3+H2Si+3HCl(3分)
③排尽装置中的空气(2分)
④将试样用稀盐酸溶解,静置取上层清液,加入氯水后再滴加几滴KSCN溶液,观察是否有红色溶液生成。(4分)
说明:只要方案设计简单,现象明显,合理均可得分。
四.(本题包括2小题,共19分)
19.⑴第三周期第VIA族(2分)
⑵C3N4(2分) 大于(1分)
⑶2Al+2OH-+2H2O=2AlO2-+3H2↑(3分)
20.⑴NaCl(2分)
⑵降低X、Y熔化时的温度,节约能源(2分)
⑶用作干燥剂(1分)
⑷2Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(3分)
2Na2O2+2H2O=4NaOH+O2(3分)
五.(本题包括1小题,共9分)
21.⑴ <(3分)
⑵2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);ΔH=-3121.6KJ/mol (3分)
⑶越少(3分)
六、(本题包括2小题,共18分)
22.⑴(2分)
⑵(2分)
(2分)
⑶ (1分) (1分)
23.⑴NaOH溶液、△(2分) 浓硫酸 、△(2分)
⑵A: (2分) F: (2分)
⑶2+O22 +2H2O(2分)
七、(本题包括2小题,共18分)
24.⑴1:1(2分)
⑵0.71(3分)
⑶6g(3分)
25.⑴2.75mol/L(3分)
⑵0(3分)
解析:设12.8g的样品中CuS的物质的量为x ,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L pH=0
⑶11.2L(4分)
解析:首先判断64g样品中CuS、Cu2S的物质的量为0.25mol
本题采用极端假设:
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
所以:c中产生气体体积(V)等于11.2L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com