
题目列表(包括答案和解析)
|
在一定条件下,a g三氧化硫气体在密闭容器中分解: 2SO3(g) 达到平衡时,容器内压强为原来的1.25倍,则平衡混合气体中各物质的量之比为: [n(SO3):n(SO2):n(O2)] | |
| [ ] | |
A. |
任意比 |
B. |
2∶2∶1 |
C. |
1∶l∶l |
D. |
4∶2∶1 |
| A、任意比 | B、2:2:l | C、1:1:l | D、4:2:1 |

(1)为防止A中液体暴沸,可以采取的措施是___________;装置D能否改用盛有浓硫酸的洗气瓶___________。
(2)反应3Fe+4H2O(g)====Fe3O4+4H2↑在一定条件下实际为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释__________________________________。
(3)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象_____________________________________________________。
(4)若E管中反应按以下两步进行:Fe3O4+H2====3FeO+H2O,FeO+H2====Fe+H2O,假设实验开始时E管中的Fe3O4为23.
①Fe ②Fe租Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉_________g(不考虑空气中的成分参与反应)。
A.SO2(g)+ O2(g) O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1 2SO3(l)ΔH=-196.6 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1 SO3(g)ΔH=-78.64 kJ·mol-1 |
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1 2SO3(g)ΔH=+196.6 kJ·mol-1 |
在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+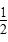 O2(g) O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1 2SO3(l)ΔH=-196.6 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1 SO3(g)ΔH=-78.64 kJ·mol-1 |
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1 2SO3(g)ΔH=+196.6 kJ·mol-1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com