
题目列表(包括答案和解析)
| ||
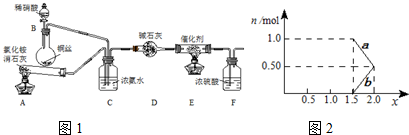
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx ![]() (2x + 3)N2 + 6xH2O
(2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲ 。
②装置D中碱石灰的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应,。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
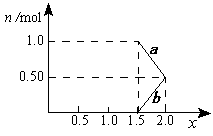
图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
把CO2通入含NaOH 0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是
A.0.44g B.0.88g C.0.66g D.0.91g
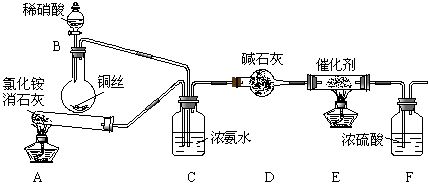
(10分)工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6
NOx  (2x
+ 3)N2 + 6xH2O
(2x
+ 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲ 。
②装置C的作用是 ▲ 。
③装置F的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
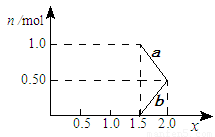
图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
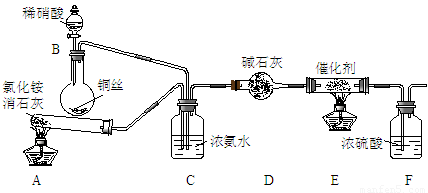
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx ![]() (2x + 3)N2 + 6xH2O
(2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:

①装置A中发生反应的化学方程式为 ▲ 。
②装置D中碱石灰的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:

图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
题号
1
2
3
4
5
6
7
8
答案
D
C
D
B
D
A
B
C
题号
9
10
11
12
13
14
答案
BD
BC
AD
B
A
D
15.(11分)
(1)1S2 2S2 2P6 3S2 3P5(1分)
(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑(2分)
(3)(共3分)促进氯气从反应混合物中逸出(1分);
稀盐酸(1分);
盐酸还原已生成的碘酸氢钾(1分)。
(4)KOH;KH(IO3)2+KOH=2KIO3+H2O(各1分,共2分)
(5)反应产生的氯气跟KOH反应生成KClO(1分),
KClO能将KIO3氧化成KIO4(1分)从而不能得到碘酸钾(1分)。(共3分)
16.(11分) ( l ) 控制气流速度 让气体混合均匀 干操混合气体.(各1 分)
 (2 ) 吸收过量的氯气(1 分) (3)分液(1 分)
(2 ) 吸收过量的氯气(1 分) (3)分液(1 分)
(4)CH4 + 2Cl
(5)A B(各得1分,选错为0) (6)2.05mol/L(2分)
17.(6分)⑴ NH2OH + 2O2― + H+= NO2― + H2O2 + H2O(2分)
⑵ 5.000×10―3 mol?L―1(2分)
⑶ 2MnO4―+5H2O2+6H+=2Mn2++5O2↑+8H2O(2分)
(或Cr2O72―+3H2O2 + 8H+ =2Cr3+ +3O2↑+7H2O)
18.(10分)(1)NH3 NaAlO2
(2)
(3) CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(HCO3-也可)
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(HCO3-也可)
(4)Al4SiC4+2N2 4AlN+SiC+
4AlN+SiC+
(每空2分,条件不写扣1 分)
19、(10分)(1)CH4(g)+H2O(g) CO(g)+3H2(g);△H=+
CO(g)+3H2(g);△H=+
(2分,条件不写扣1分)
(2)增大氮气和氢气的浓度有利于增大反应速率;减小氨气的浓度,增大氮气和氢气的浓度都有利于平衡向正反应方向移动。(各1分)
(3)1.12×108(2分)
(4) (各2分)
(各2分)
20、(16分)(Ⅰ)(1) (2分)(2)③,⑤ (各1分)
(2分)(2)③,⑤ (各1分)
|