
题目列表(包括答案和解析)
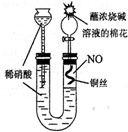
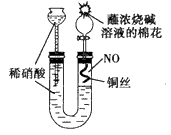
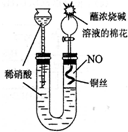 (2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.
(2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.某同学设计如图所示装置分别进行探究实验(夹持装置已略去)

| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | NO | H2O |
| ② | FeCl3溶液、双氧水 | H2O | |
| ③ | Zn、稀H2SO4 | H2 | H2O |
| ④ | NaOH固体、浓氨水 | NH3 | |
| ⑤ | Na2CO3固体、稀H2SO4 | CO2 | |
| ⑥ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
① ,
② ,③视线与凹液面最低处相平。
(2)实验②收集的气体是 。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是 。
(4)实验④、⑤中,量气管中的液体分别是 、 。
A.稀H2SO4 B.CCl4 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)在25℃,101kPa条件下,取![]() =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 20.0mL | 382.2mL |
| 2 | 1.0g | 20.0mL | 360.0mL |
| 3 | 1.0g | 20.0mL | 377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
(15分)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | NO | H2O |
| ② | FeCl3溶液、双氧水 |
| H2O |
| ③ | Zn、稀H2SO4 | H2 | H2O |
| ④ | NaOH固体、浓氨水 | NH3 |
|
| ⑤ | Na2CO3固体、稀H2SO4 | CO2 |
|
| ⑥ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
① ,
② ,③视线与凹液面最低处相平。
(2)实验②收集的气体是 。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是 。
(4)实验④、⑤中,量气管中的液体分别是 、 。
A.稀H2SO4 B.CCl4 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)在25℃,101kPa条件下,取![]() =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 20.0mL | 382.2mL |
| 2 | 1.0g | 20.0mL | 360.0mL |
| 3 | 1.0g | 20.0mL | 377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com