
题目列表(包括答案和解析)
(10分)某同学做元素性质递变规律实验时,
设计了一套实验方案,记录了有关实验现象。
| 实验步骤 | 实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ | |
| 实验现象(填A-D) | | | | | |
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
【小题1】该反应的化学方程式为 ;(只写第二步)
【小题2】水槽中盛放的液体最好为 ;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
(13分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
(本题共15分)空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
【小题1】方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如下图所示。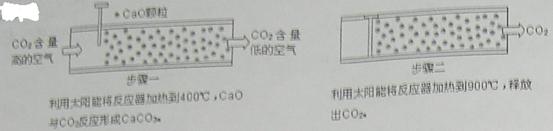
(1)步骤一中的CaO俗称 。
(2)步骤二中发生反应的化学方程式是 ,该反应 (填“是”或“不是”)步骤一中反应的逆反应。
【小题2】方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如右图所示。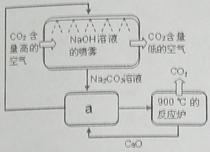
(1)NaOH溶液喷成雾状是为了 。
(2)右图a环节中,物质分离的基本操作是 。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和 。
【小题3】下列溶液中,同样能用于“捕捉”二氧化碳的是( )。
| A.KNO3溶液 | B.CaCl2溶液 | C.CuSO4溶液 | D.Na2CO3溶液 |
| A.①③ | B.①② | C.②④ | D.③④ |
【小题1】 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质 |
| C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质 |
| D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com