
题目列表(包括答案和解析)
| ||
| ||
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
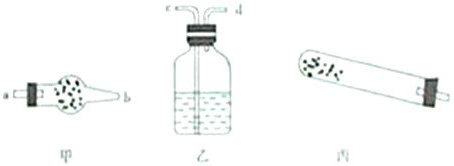
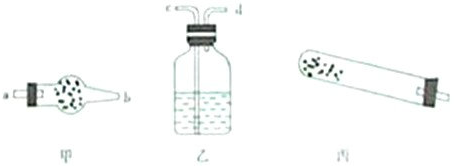
| 仪器 | 试管 | 干燥管 干燥管 |
洗气瓶 洗气瓶 |
| 药品 | 碱式碳酸铜 | 无水硫酸铜 无水硫酸铜 |
澄清石灰水 澄清石灰水 |
| △ |
| △ |
| ||
| ||
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下:
请回答:
(1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。
(2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。
(3)MgO的熔点高于CuO的原因为______________________________________。
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下:
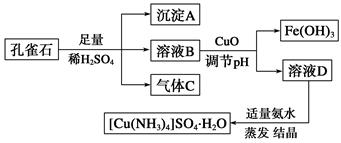
请回答:
(1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。
(2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。
(3)MgO的熔点高于CuO的原因为______________________________________。
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com