
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
(1)写出实验室用冰醋酸和无水乙醇制乙酸乙酯的化学方程式:
CH
3CH
2OH+CH
3COOH
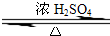
CH
3COOCH
2CH
3+H
2O
CH
3CH
2OH+CH
3COOH
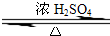
CH
3COOCH
2CH
3+H
2O
.
(2)为使反应物充分反应,以下措施中正确的是
①④
①④
(填写对应序号).
①先小火温热,再慢慢升温至微沸状态 ②先大火加热至沸腾状态,并持续加热保持沸腾状态 ③使用稀硫酸作催化剂 ④作用浓硫酸作催化剂
(3)如果单孔塞上的导管短一些,对乙酸乙酯的收集有何影响,简述原因.
答:
使乙酸乙酯得不到充分的冷凝而使收集量减少,导管要足夠长才能确保产物得到充分冷凝
使乙酸乙酯得不到充分的冷凝而使收集量减少,导管要足夠长才能确保产物得到充分冷凝
.
(4)A同学将收集到的乙酸乙酯滴入含有少量酚酞的NaOH溶液中并在水浴中温热,发现溶液的红色逐渐变浅,由此得出乙酸乙酯中含有乙酸的结论,你认为这一结论正确吗?为什么?
答:
不正确,乙酸乙酯在碱性条件下会发生水解,生成的乙酸也可中和NaOH从而使酚酞褪色,故酚酞褪色不能肯定是含有乙酸造成的
不正确,乙酸乙酯在碱性条件下会发生水解,生成的乙酸也可中和NaOH从而使酚酞褪色,故酚酞褪色不能肯定是含有乙酸造成的
.
(5)B同学将收集到的乙酸乙酯滴入饱和NaHCO
3溶液中,观察到有少量气泡产生,可得出的结论是
乙酸乙酯中含有乙酸
乙酸乙酯中含有乙酸
,该过程中发生反应的化学方程式是
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
.
(6)C同学将收集到的乙酸乙酯缓缓滴入饱和Na
2CO
3溶液中,无气泡产生,于是得出该乙酸乙酯中不含乙酸的结论.请你运用所学知识,评价该同学的结论是否正确.
我的评价是:
不正确,因乙酸和Na2CO3反应首先生成NaHCO3而不放出气泡,当Na2CO3全部转化为NaHCO3后,乙酸才与NaHCO3反应生成CO2,产生气泡,所以,没有气泡产生,并不能说明其中不含有乙酸
不正确,因乙酸和Na2CO3反应首先生成NaHCO3而不放出气泡,当Na2CO3全部转化为NaHCO3后,乙酸才与NaHCO3反应生成CO2,产生气泡,所以,没有气泡产生,并不能说明其中不含有乙酸
.

 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题: 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙 酸 乙 酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O