
题目列表(包括答案和解析)
(10分)实验室要配制100 mL0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是( )
A.锥形瓶 B.200mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是__________________________。
(3)容量瓶上除有刻度线外还应标有__________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
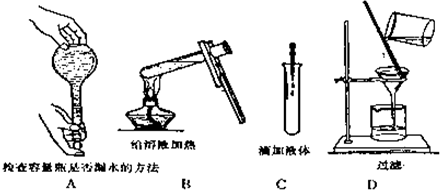
(共15分)化学是以实验为基础的学科,检查装置气密性是化学实验中的重要操作之一。请按要求回答下列问题:
(1)(2分)下列仪器或装置在使用前一定要检查气密性的是________(填序号,下同).
A.容量瓶 B.洗气瓶 C.分液漏斗 D.酸(碱)式滴定管
(2)(2分)下列关于不进行气密性检查可能导致不良后果的叙述中,正确的是________.
A.收集不到气体 B.造成环境污染
C.观察到的实验现象有误 D.引发爆炸事故
(3)(3分)为检查如图所示简易气体发生装置的气密性,甲同学进行了以下操作和方案设计。甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他的方案可行。请补充完善甲同学的操作方案、现象和结论:____ _____。
(4)(2分)化学实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(5)(6分)图是某同学在配制150 mL 0.2mol/L NaCl溶液时转移溶液的示意图,图中的两处错误是:_________________、____________________。
若在定容时仰视,则所配溶液的浓度_________(填“偏高、偏低、不影响”)。 若定容不慎超过刻度线,应采用的处理方法是:__________________。
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 2.00 | 21.99 |
| 2 | 20.00 | 0.80 | 23.42 |
| 3 | 20.00 | 1.02 | 21.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com