
题目列表(包括答案和解析)
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内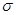 键和
键和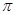 键的比为
。
键的比为
。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为 ;
(3)As原子序数为 ,其核外M层和N层电子的排布式为 ;
(4)NH3的沸点比PH3 (填“高”或“低”),原因是 .PO43-离子的立体构型为 ;
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13.硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因 ;
②硝酸比亚硝酸酸性强的原因 ;
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 cm(用含有a的代数式表示).在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为 g (氧离子的半径为1.40×10-10m)

VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为????????????? 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为????????????????????? 。
(3)NH3的沸点比PH3高,原因是??????????? ;PO43-离子的立体构型为?????????????? 。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为?????????? 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因??????????????????????????? 。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为 ??? g/cm3(只要求列算式,不必计算)。
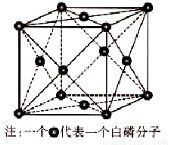
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为????????????? 。
(2)N、P、As原子的第一电离能由大到小的顺序为????????????? 。
(3)NH3的沸点比PH3高,原因是? ??????????????????????????????? ????????? ;PO43-离子的立体构型为?????????????? 。
(4)PH3分子中P原子采用????? 杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因????????????? ?????????????????? ????????????? 。
(6)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为??????????? 。
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内键和
键的比为 。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com