
题目列表(包括答案和解析)
(11分)已知稀硝酸与铜反应时,NO3—一般被还原为NO;浓硝酸与铜反应时,NO3—一般被还原为NO2。现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。
(1)被还原的硝酸的物质的量为: 。
(2)25.6gCu与50mL12mol/L的硝酸反应后,剩余物为: ,
其物质的量为: 。
(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入 L(标况)O2才能使溶液充满烧瓶。
(4)如果往反应后的体系内再加入200mL4mol/L的稀硫酸,是否有气体逸出?若有,计算生成气体在标况下的体积(要求有简单过程,结果保留三位有效数字)。
(11分)已知: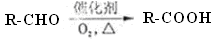
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下:
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______ 。
(11分)已知:
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下:
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______ 。
(11分)已知稀硝酸与铜反应时,NO3—一般被还原为NO;浓硝酸与铜反应时,NO3—一般被还原为NO2。现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。
(1)被还原的硝酸的物质的量为: 。
(2)25.6gCu与50mL12mol/L的硝酸反应后,剩余物为: ,
其物质的量为: 。
(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入 L(标况)O2才能使溶液充满烧瓶。
(4)如果往反应后的体系内再加入200mL4mol/L的稀硫酸,是否有气体逸出?若有,计算生成气体在标况下的体积(要求有简单过程,结果保留三位有效数字)。
(共10分)已知铜的摩尔质量M=6.4×10-2 kg/mol,铜的密度 =8.9×103kg/m3,阿伏加德罗常数NA=6.0×1023mol-1。试估算:(计算结果保留2位有效数字)。
(1)一个铜原子的质量。
(2)若每个铜原子可提供两个自由电子,则3.0×10-5m3的铜导体中有多少个自由电子?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com