
题目列表(包括答案和解析)
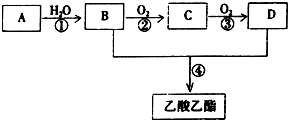 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工发展水平.
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工发展水平.| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
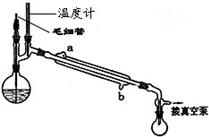
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
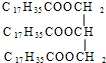 +3NaOH
+3NaOH | 加热 |

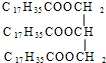 +3NaOH
+3NaOH | 加热 |

| 混合物 | 试剂 | 分离方法 | 主要仪器 |
| 甲烷(乙烯) | 溴水 溴水 |
洗气 洗气 |
洗气瓶 洗气瓶 |
| 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 饱和Na2CO3溶液 |
分液 分液 |
分液漏斗 分液漏斗 |
| 肥皂(甘油) | NaCl NaCl |
( 盐析)过滤 ( 盐析)过滤 |
漏斗、烧杯 漏斗、烧杯 |
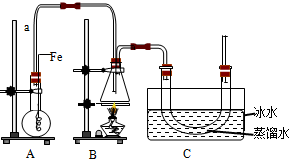
按下图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.实验仪器D主要起到洗气的作用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com