
题目列表(包括答案和解析)
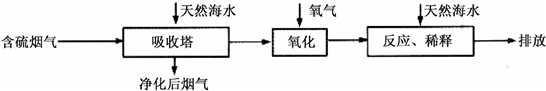
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
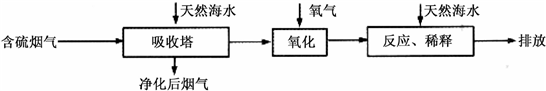
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| O | 2- 3 |
| O | 2- 4 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 4 |
| O | - 3 |
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 用胶头滴管取少量样品溶液加入试管中,再用胶头滴管取过量的1mol?L-1氯化钡溶液并滴加到此试管中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中 | 产生白色沉淀 |
| ② | ||
| ③ | ||
| ④ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com