
题目列表(包括答案和解析)
反应2A(气)![]() 2B(气)+C(气)(正反应为吸热),已达平衡,欲使B的物质的量减小,应采取的措施是:
2B(气)+C(气)(正反应为吸热),已达平衡,欲使B的物质的量减小,应采取的措施是:
A.升温 B.加压 C.增大A的浓度 D.加催化剂
反应2A(气)![]() 2B(气)+E(气)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(气)+E(气)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压
B.减压
C.减小E的浓度
D.降温
A.加压
B.减压
C.减小E的浓度
D.降温
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
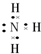
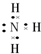
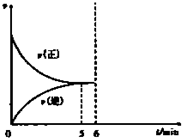 向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:
向一个容积为2L的恒温容密闭容器中通入2molA,发生如下反应:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com