
题目列表(包括答案和解析)
?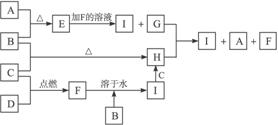
1)四种物质的名称:B__________,C___________,H____________,G_______________;
(2)物质I溶液的颜色呈_______________色,物质A的颜色是_________________色;
(3)B物质在化学反应中,与强氧化剂反应通常生成______价的化合物,与较弱氧化剂反应通常生成____________价的化合物;
(4)用实验方法鉴别H和I可用___________试剂,现象是_______________,并写出由H制取I的化学方程式________________________;
(5)G+H→I+A+F的离子方程式________________________________________________。
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶于水成为无色溶液,G溶于水得棕黄色溶液。这九种物质间反应的转化关系如下图所示
(1)写出四种单质的化学式
A_________ B________ C_________ D________
(2)写出E+F→H+I的离子方程式 ;
(3)写出G+I→H+D+E的化学反应方程式 。
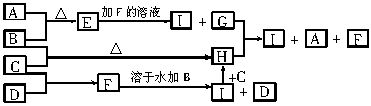
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶于水成为无色溶液,G溶于水得棕黄色溶液。这九种物质间反应的转化关系如下图所示

(1)写出四种单质的化学式
A_________ B________ C_________ D________
(2)写出E+F→H+I的离子方程式 ;
(3)写出G+I→H+D+E的化学反应方程式 。
A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示
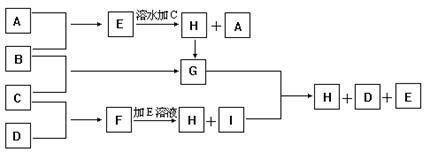
(1)写出四种单质的化学式
A____ _____ B__________ C__ ____ D___ _____
(2)写出E+F→H+I的离子方程式
(3)写出G+I→H+D+E的化学方程式
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com