
题目列表(包括答案和解析)
实验室有一瓶可能含有NaCl、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种杂质的
中的一种或几种杂质的![]() ,通过下列实验确定该样品的成份及
,通过下列实验确定该样品的成份及![]() 的质量分数.
的质量分数.
称取样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标况),向逸出气体后的溶液中加入稍过量的![]() 溶液,得白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色.请根据实验填写以下空白:
溶液,得白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色.请根据实验填写以下空白:
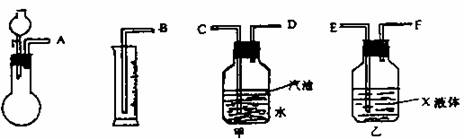
(1)若用下图所示仪器组装进行上述实验,气流从左至右,各仪器的正确连接顺序为________接________,________接________,________接________;X溶液是________,汽油的作用是________.

(2)操作时,怎样才能正确地测出放出气体的体积?
________________________________________________________
________________________________________________________
(3)若实验中加入硫酸溶液的体积为5.00mL,则样品中![]() 的质量分数是________,一定含有的杂质是________.(通过计算回答)
的质量分数是________,一定含有的杂质是________.(通过计算回答)
称取样品
请根据实验填写以下空白:

(1)若用上图所示仪器组装进行上述实验,气流从左到右,各仪器的正确连接顺序为______接 , 接 , 接 ;X溶液是 ,汽油的作用是 。
(2)操作时,怎样才能正确地测出放出气体的体积?
(3)若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 ,一定含有的杂质是 (通过计算回答)。

(1)若用下图所示仪器组装进行上述实验,气流从左到右,各仪器的正确连接序为________接________,________接________,________接________;X溶液是________,汽油的作用是________。
(2)操作时,怎样才能正确地测出放出气体的体积?
(3)若实验中加入硫酸溶液的体积为5.0mL,则样品中Na2SO3的质量分数是________,一定含有的杂质是(通过计算回答)。
称此样品6.30 g,加入6.0 mol·L-1的硫酸至过量,产生无色气体560 mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32 g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
(1)若用下图所示仪器组装进行上述实验,气体从左到右各仪器的正确连接顺序为_______接_______,_______接________,______接________;X溶液是_____________,汽油的作用是___________________________________________________。

(2)操作时,怎样才能正确地测出放出气体的体积?__________________________________。
(3)若实验中加入硫酸溶液的体积为5.00 mL,则样品中Na2SO3的质量分数是多少(写出计算过程)。
(4)相关离子方程式是___________________________________________________。
(5)一定含有的杂质是什么?(写出计算过程)
实验室有一瓶Na2SO4固体,可能含有NaCl、Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。称此样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
(1)若用下图所示仪器组装进行上述实验,气流从左到右各仪器的正确连接顺序为(填编号字母) 接 , 接 , 接 ,液体X是 ,汽油的作用是 。
(2)若实验中加入硫酸溶液的体积为5.00mL,则样品Na2SO3质量分数是 ;样品中杂质的成分及其质量为 。
15、(12分) (1)Mg2+、Al3+、NO 、SO
、SO (4分)
(4分)
(2)Fe2+、Ba2+、I-、HCO (4分)
(4分)
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(4分)
16、⑴C、D、F、E; ⑵10;⑶浓硫酸,干燥SO2 ⑷A、D ⑸⑤
⑹42%(或0.42);NaCl、Na2SO4
17、I.(1)溶液显色所需要的时间。
(2)①2NO+O2+4CO 4CO2+N2(3分);②-1160 kJ?mol-1;
4CO2+N2(3分);②-1160 kJ?mol-1;
(3)①该研究只能提高化学反应速率,不能使化学平衡发生移动、 D
II.NO2(2)NH4NO3 N2O+2H2O(3分)
N2O+2H2O(3分)
18、 (1) 、
、 、Mg2+(2)氟,2H2O+
、Mg2+(2)氟,2H2O+
(3)  2CO↑+Si (4)2Mg+CO2
2CO↑+Si (4)2Mg+CO2 2MgO+C
2MgO+C
19、Ⅰ.
 Ⅱ.(1)HgCl2 HgCl++Cl―(1分);
Ⅱ.(1)HgCl2 HgCl++Cl―(1分);
2Fe2++2HgCl2=Hg2Cl2↓+2Fe3++2Cl―(2分);
K=[Fe3+]2―[Cl―]2/[Fe2+]2[HgCl2]2(2分)
(2)不能。因为加热能促进氯化铝水解,且氯化氢逸出也使平衡
|