
题目列表(包括答案和解析)
| 16 |
| a2 |
| 16 |
| a2 |
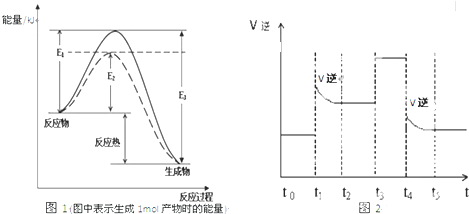
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
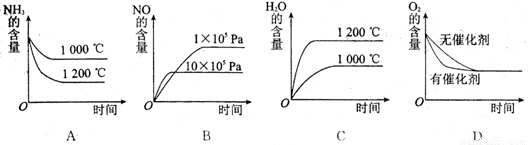
(2)若其他条件不变,下列关系图中错误的是 (选填序号)
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
|
浓度(mol/L) 时间(min) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
|
起 始 |
4.0 |
5.5 |
0 |
0 |
|
第2min |
3.2 |
x |
0.8 |
1.2 |
|
第4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
第6min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸 吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是 (选填序号)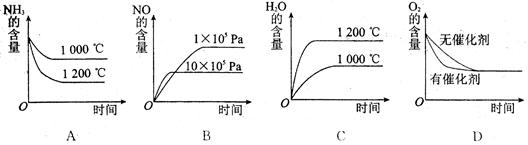
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度(mol/L) 时间(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起 始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | x | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
 4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
| 浓度(mol/L) 时间(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起 始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | x | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
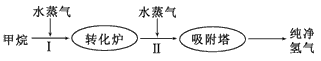
 H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表: 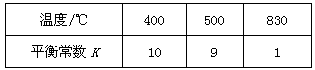

第Ⅰ卷 (选择题共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1、C 2、B 3、B 4、A 5、C 6、A 7、D 8、D
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、D 10、BC 11、AD 12、A 13、C 14、B
第Ⅱ卷 (选择题共72分)
三、(本题包括1小题,共10分)
15.(10分) 每空2分
I AB
II(1)SiO2 (2)保持较大的C2O42-离子浓度,使Ca2+沉淀完全。
(3)降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差。
(4) 或
或 %
%
四、(本题包括2小题,共18分)
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ?mol-1 (2分)
2SO3(g) △H=-196.6 kJ?mol-1 (2分)
 (3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)错误!链接无效。
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)错误!链接无效。
17.(10分)
(1) (2分)
(2)8Al+3Fe3O4 4Al2O3+9Fe (2分)
4Al2O3+9Fe (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)③ (2分)
五、(本题包括1小题,共10分)
18.(10分)(每空2分)
 (1) ③⑤
(1) ③⑤
(2)
(3) ①如2Na+2H2O=2Na++2OH-+H2↑;
②如CH3COOH+NH3×H2O=CH3COO-+NH4++H2O;
③如Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
六、(本题包括1小题,共12分)
19.( 12分)每空2分
12分)每空2分
⑴过滤 低温蒸发结晶
⑵(如图或其他能防止氨气倒吸的装置)
⑶ 冷凝管
⑷ ① 2CaSO4
2CaO+2SO2↑+O2↑
2CaSO4
2CaO+2SO2↑+O2↑
② 95.6%
七、(本题包括1小题,共8分)
20.(8分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol
n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (2分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (2分)
八、(本题包括1小题,共14分)
21.(14分)
(1)相同 b (每空1分)
(2)B(2分)
(3)I.3d24S2 (2分) II.[TiCl(H2O)5]Cl2?H2O(2分)
(4)I.KO2 kJ?mol-1 (每空2分,共
射阳中学2009届高三上学期第二次月考
化 学 答 题 纸
三、(本题包括1小题,共10分)
15.(10分)
I
II(1)
(2)
(3)
(4)
四、(本题包括2小题,共18分)
16.(8分)
(1)
(2)
(3)
(4)
17.(10分)
(1)
(2)
(3)
(4)阳极 阴极
五、(本题包括1小题,共10分)
18.(10分)
(1)
(2) 
(3) 请在下列表格中用相应的“离子方程式”否定这些观点。
①所有的离子方程式均可以表示一类反应
②酸碱中和反应均可表示为:H++OH-=H2O
③离子方程式中凡是难溶性酸碱盐(产物)均要用“↓”
六、(本题包括1小题,共12分)
19.(12分)
(1)
(2) 
(3)
(4)①
②
七、(本题包括1小题,共8分)
20.(8分)
(1)
(2)
(3)
八、(本题包括1小题,共14分)
21.(14分)
(1)
(2)
(3)I II
(4) I II
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com