
题目列表(包括答案和解析)
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z•nH2O。工业上常用的一种制备流程为:

在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度=![]() 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。
。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。
试回答下列问题。
(1)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。该固体聚合硫酸铁的盐基度为 ▲ 。Ks5u
(2)该固体聚合硫酸铁样品的化学式为 ▲ 。
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z?nH2O。工业上常用的一种制备流程为:
![]()
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。试回答下列问题。
(1)写出在酸性介质中用NaClO3氧化FeSO4?7H2O的离子方程式。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过
滤、洗涤、干燥得白色沉淀10.48 g,向上述滤液中加入NH3?H2O,调节溶液pH=6,经过滤、
洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。
(3)计算出该固体聚合硫酸铁样品的化学式。
(8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度=![]() × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式 。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为 。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为 。
(8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度=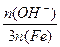 × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式 。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为 。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为 。
(8分)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:

在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度=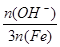 × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
(1)写出在酸性介质中用NaClO3氧化绿矾(FeSO4·7H2O)的离子方程式 。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485 g,向上述滤液中加入NH3·H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度为 。
(3)计算出该固体聚合硫酸铁样品的化学式(x、y、z、n均取整数)为 。
第Ⅰ卷 (选择题共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1、C 2、B 3、B 4、A 5、C 6、A 7、D 8、D
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、D 10、BC 11、AD 12、A 13、C 14、B
第Ⅱ卷 (选择题共72分)
三、(本题包括1小题,共10分)
15.(10分) 每空2分
I AB
II(1)SiO2 (2)保持较大的C2O42-离子浓度,使Ca2+沉淀完全。
(3)降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差。
(4) 或
或 %
%
四、(本题包括2小题,共18分)
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ?mol-1 (2分)
2SO3(g) △H=-196.6 kJ?mol-1 (2分)
 (3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)错误!链接无效。
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)错误!链接无效。
17.(10分)
(1) (2分)
(2)8Al+3Fe3O4 4Al2O3+9Fe (2分)
4Al2O3+9Fe (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)③ (2分)
五、(本题包括1小题,共10分)
18.(10分)(每空2分)
 (1) ③⑤
(1) ③⑤
(2)
(3) ①如2Na+2H2O=2Na++2OH-+H2↑;
②如CH3COOH+NH3×H2O=CH3COO-+NH4++H2O;
③如Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
六、(本题包括1小题,共12分)
19.( 12分)每空2分
12分)每空2分
⑴过滤 低温蒸发结晶
⑵(如图或其他能防止氨气倒吸的装置)
⑶ 冷凝管
⑷ ① 2CaSO4
2CaO+2SO2↑+O2↑
2CaSO4
2CaO+2SO2↑+O2↑
② 95.6%
七、(本题包括1小题,共8分)
20.(8分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol
n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (2分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (2分)
八、(本题包括1小题,共14分)
21.(14分)
(1)相同 b (每空1分)
(2)B(2分)
(3)I.3d24S2 (2分) II.[TiCl(H2O)5]Cl2?H2O(2分)
(4)I.KO2 kJ?mol-1 (每空2分,共
射阳中学2009届高三上学期第二次月考
化 学 答 题 纸
三、(本题包括1小题,共10分)
15.(10分)
I
II(1)
(2)
(3)
(4)
四、(本题包括2小题,共18分)
16.(8分)
(1)
(2)
(3)
(4)
17.(10分)
(1)
(2)
(3)
(4)阳极 阴极
五、(本题包括1小题,共10分)
18.(10分)
(1)
(2) 
(3) 请在下列表格中用相应的“离子方程式”否定这些观点。
①所有的离子方程式均可以表示一类反应
②酸碱中和反应均可表示为:H++OH-=H2O
③离子方程式中凡是难溶性酸碱盐(产物)均要用“↓”
六、(本题包括1小题,共12分)
19.(12分)
(1)
(2) 
(3)
(4)①
②
七、(本题包括1小题,共8分)
20.(8分)
(1)
(2)
(3)
八、(本题包括1小题,共14分)
21.(14分)
(1)
(2)
(3)I II
(4) I II
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com