
题目列表(包括答案和解析)
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |

| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
| ||
| ||
| 实验操作 | 现象 | 结论 |
| 步骤一: 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 |
产生蓝色沉淀 | 猜想一不成立 猜想一不成立 |
| 步骤二: 往探究活动III溶液中加入乙醚,充分振荡 往探究活动III溶液中加入乙醚,充分振荡 |
乙醚层呈血红色 乙醚层呈血红色 |
“猜想二”成立 |
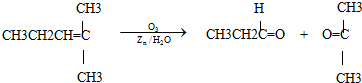
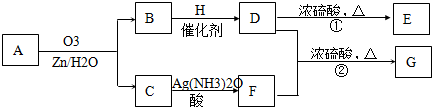
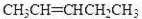
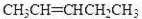

| m |
| 100 |
| m |
| 12 |
| m |
| 100 |
| m |
| 12 |
| n(CaCO3) |
| n(C) |
| n(CaCO3) |
| n(C) |
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
C
C
B
B
题号
9
10
11
12
13
14
15
16
17
18
答案
D
A
A
AB
AD
C
C
C
BC
C
19.A
20.①I-、Ba2+、NH4+
②Fe3+、NO3-、Mg2+、SO42-、CO32-、Al3+
③K+、Cl-
21.(1)C F G
(2)Fe3+ +3NH3H2O=Fe(OH)3 ↓+ 3 NH4+
(3)6Fe2+ + ClO3― + 6 H+ = 6Fe3+ + Cl― + 3H2O ,无影响,3:1
(4)坩埚
继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过
 (5)
(5) 4次
4次
×2× g×100%
g×100%
22.(1)H2O2溶液或H2O,少量的MnO2粉末或Na2O2;C。
(2)排水法收集--广口瓶中盛满水 , NO 从 d 管通入
(3)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色(黄色)
23.4NxHy+yO2 →2xN2+2yH2O 反应前后质量守恒,同温同压下气体密度与气体体积成反比 x=2,y=4 N2H4

24.(1)n(NaClO)┱n(NaClO3)=1┱2
(2)7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O
(3)c(NaClO)=0.2mol/L
c(NaClO3)=0.4moL/L c(NaCl)=2.2mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com