
题目列表(包括答案和解析)
过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
|

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4![]() (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2

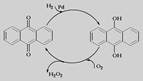
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
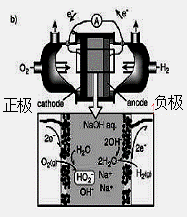
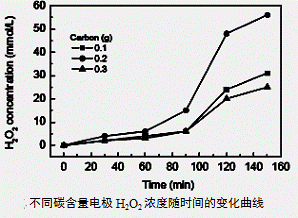
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚: 。
|

 (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,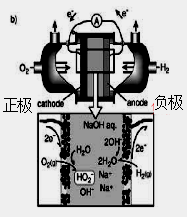

过氧化氢(H2O2)是一种无色透明粘稠状液体,它的水溶液俗称双氧水,呈弱酸性,一种强氧化剂,漂白剂,消毒剂,是生产过氧化物的原料.
(1)写出H2O2的电子式_________________,
(2)H2O2与强碱反应可生成正盐,一定条件下也生成酸式盐,写出NaOH与H2O2反应生成酸式盐的化学方程式:____________________.
(3)在H2O2中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:________________
②这个反应是否是氧化还原反应?________,其理由是________
(4)双氧水属于________(A强电解质、B弱电解质、C非电解质、D以上都错),它被称为“绿色氧化剂”,理由是__________________________________.
I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值。
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成。(已知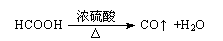 )
)

试回答下列问题:
(1)仪器的连接顺序为
(2)E装置的作用是___________________、___________________________________________。
(3)写出D中的NOX与CO反应的化学方程式______________________________________。
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________。
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:___________________________________________。
I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值。
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成。(已知)
试回答下列问题:
(1)仪器的连接顺序为
(2)E装置的作用是___________________、___________________________________________。
(3)写出D中的NOX与CO反应的化学方程式______________________________________。
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_________________________________________________________。
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:___________________________________________。
第Ⅰ卷(选择题 共48分)
题号
1
2
3
4
5
6
7
8
答案
A
C
C
C
B
B
A
D
题号
9
10
11
12
13
14
答案
AB
D
C
B
BD
CD
第Ⅱ卷(非选择题部分 共72分)
15.(10分)(1)①B(1分) ②蒸馏烧瓶(1分) ③气密性检查(2分)
④大气压(或开始时烧瓶内的压强)(1分) 强(1分)
开始一段时间内曲线a的变化值大于曲线b。(2分)
(2)①有利于控制氧气的量 ②有利于二氧化锰的回收
③有利于控制氧气的生成速率(答出任意两点即可,每空1分)
16.(12分)(1)② 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- (2分)
 |
⑤ NH4++HCO3-+2OH- CO32-+NH3↑+2H2O(2分)
(2)过滤(1分) 加热(1分) (3)碱石灰(或硅胶)(1分)
(4)AlN(2分) 配位键(1分)
(5)产生等量的NH3时,(NH4)2CO3所消耗的NaOH的量是NH4HCO3一半。(2分)
17.(10分)⑴ 0.125 4.69 ⑵增大 > ⑶0.25 不变 (以上每空1分)
(4)6 1.25 (每空2分)
18.(10分)(1)②⑥(2分)
(2)C: (1分) F:
(1分) F:
 (1分)
(1分)
(3)
|