
题目列表(包括答案和解析)
 2(t-BuNO) 。
2(t-BuNO) 。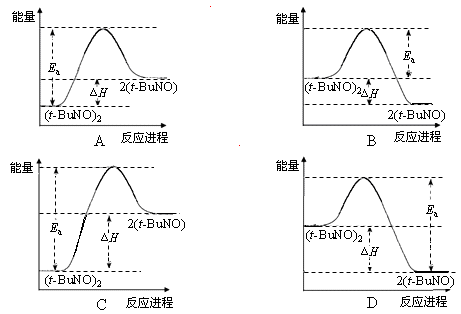
 ____ 0(填“>”、“<”或“=”)。在 ________ (填“较高”或“较低”)温度下有利于该反应自发进行。
____ 0(填“>”、“<”或“=”)。在 ________ (填“较高”或“较低”)温度下有利于该反应自发进行。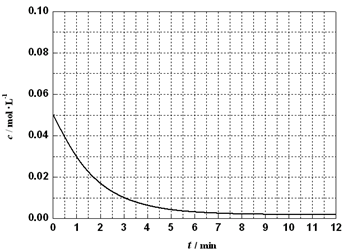
不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取
硝酸钾就是利用了该原理。请你回答以下问题:
1.右图是几种盐的溶解度曲线,下列说法正确是
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析 出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中, 蒸发时,先析出的是氯化钠
2.从右图曲线中可以分析得到KNO3和NaCl的溶解度随温度变化的关系是 。
3.请填写空白。
步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① |
溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | NaNO3和KCl溶于水后产生四种离子,这四种离子可能组成四种物质 、 、 、 。这四种物质在不同温度下的溶解度特点 |
② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 晶体析出。 |
③ |
| 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 。 |
④ | 冷却 | 将滤液冷却至室温。 | 有 晶体析出。尚有少量的 析出。 |
⑤ |
| 按有关要求进行操作 | 得到初产品硝酸钾晶体(称量为m1) |
⑥ |
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体(称量为m2) |
⑦ |
检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1d1mol/l的HNO3和2d0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是
|
(1)检验所得产品中是否Cl-的目的是 。结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。(不考虑损失)
(2)步骤③过滤使用了保温漏斗,用图所示装置,其主要作用是

(3)步骤③过滤装置如图1―8所示,采用这种装置过滤的主要目的是 
这种装置工作的主要原理是
(4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,上述实验步骤中一般需要用到玻璃棒的是_______________(填代号).
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 ![]() 2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。

(4)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器 是 。
A.pH计 B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。

 2(t-BuNO).
2(t-BuNO).

1
2
3
4
5
6
7
8
D
B
C
A
C
D
D
C
9
10
11
12
13
14
╆╆╆╆╆
╆╆╆╆╆
CD
D
D
CD
B
AD
~~~~~
~~~~~
15.每空均2分,共10分
(1)吸附水中有色物质(脱色);(2)S2-+H2O2=S+2OH―(或:S2-+H2O2+2H+=S↓+2H2O);(3)将水样可能含有的高铁离子及铬酸盐还原;(4)偏低
(5)V1×2c×35.5×1000/V=71000CV1/V
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)
 |
17.(10分)
(1) (2分)
(2)2FeCl2+Cl2===2FeCl3 (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)错误!未找到引用源。 (2分)
18.⑴S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
⑵2.7×10-3 ⑶172.5 ⑷使BaSO4得到充分的还原(或提高BaS的产量)
①②为吸热反应,炭和氧气反应放热维持反应所需高温
19.(12分)
(1)D(2分)
(2)Cu(1分)
(3)H2(1分);①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分)(1分)
20.(共10分)
(1)解: 2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
起始浓度/ mol?L-1 0.050 0.030 0
平衡浓度/ mol?L-1 (0.050-0.040) (0.030-0.040/2) 0.040
= 0.010 = 0.010
所以,K = =
=  = 1.6×103 mol?L-1。(不带单位计算也得分)
= 1.6×103 mol?L-1。(不带单位计算也得分)
(SO2)
= ×100%
= 80% 。
×100%
= 80% 。
(2)B、C。 (3)SO2+H2O+Na2SO3=2NaHSO3。
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+。
21.(12分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (3分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com