
题目列表(包括答案和解析)
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
A.电解时以硫酸铜溶液作电解液,精铜作阳极
B.粗铜与电源负极相连,发生氧化反应
C.阴极上发生的反应是Cu2++2e-=Cu
D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2++2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2++2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
|
下列说法正确的是 | |
| [ ] | |
A. |
电解法精炼铜时,阳极溶解的铜与阴极析出的铜质量相等 |
B. |
工业上电解饱和食盐水时,应将饱和NaC1溶液导入阴极室中 |
C. |
钢铁表面水膜接近中性时,发生电化学腐蚀的负极 反应为:2H2O+O2+4e-=4OH- |
D. |
便携式固体氧化物燃料电池如图:b电极为负极,其电极反应式为:C3H8-20e-+10O2-=3CO2+4H2O萃取出碘.
|
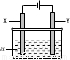
| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
1
2
3
4
5
6
7
8
D
B
C
A
C
D
D
C
9
10
11
12
13
14
╆╆╆╆╆
╆╆╆╆╆
CD
D
D
CD
B
AD
~~~~~
~~~~~
15.每空均2分,共10分
(1)吸附水中有色物质(脱色);(2)S2-+H2O2=S+2OH―(或:S2-+H2O2+2H+=S↓+2H2O);(3)将水样可能含有的高铁离子及铬酸盐还原;(4)偏低
(5)V1×2c×35.5×1000/V=71000CV1/V
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)
 |
17.(10分)
(1) (2分)
(2)2FeCl2+Cl2===2FeCl3 (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)错误!未找到引用源。 (2分)
18.⑴S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
⑵2.7×10-3 ⑶172.5 ⑷使BaSO4得到充分的还原(或提高BaS的产量)
①②为吸热反应,炭和氧气反应放热维持反应所需高温
19.(12分)
(1)D(2分)
(2)Cu(1分)
(3)H2(1分);①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分)(1分)
20.(共10分)
(1)解: 2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
起始浓度/ mol?L-1 0.050 0.030 0
平衡浓度/ mol?L-1 (0.050-0.040) (0.030-0.040/2) 0.040
= 0.010 = 0.010
所以,K = =
=  = 1.6×103 mol?L-1。(不带单位计算也得分)
= 1.6×103 mol?L-1。(不带单位计算也得分)
(SO2)
= ×100%
= 80% 。
×100%
= 80% 。
(2)B、C。 (3)SO2+H2O+Na2SO3=2NaHSO3。
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+。
21.(12分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (3分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com