
题目列表(包括答案和解析)
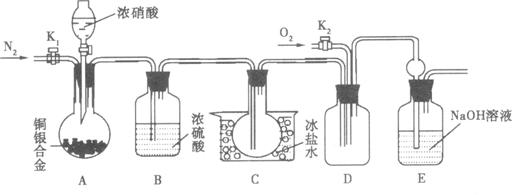
请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生反应的化学方程式;______________________。
(2)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这
样做的目的是______________________________________________;装置中B瓶的作用是____________________________________________________________________。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__________________;实验发现,通入氧气温度的高低对实验现象有较大影响,为便于观察应通入___________(填“冷”或“热”)的氧气。
(4)已知合金的质量为a,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以达到目的。请简述实验过程:_____________________。
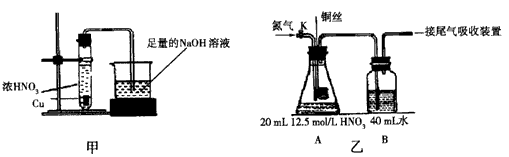
I.下图是一个制取氯气并以氯气为原料进行特定反应的装置。
试回答下列问题:
(1)实验开始时,先点燃A处的酒精灯,打开旋塞K,让![]() 充满整个装置,再点燃D处的酒精灯,连接上E装置,
充满整个装置,再点燃D处的酒精灯,连接上E装置,![]() 通过C瓶后进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为
通过C瓶后进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为![]() 和HCl,试写出D中发生反应的化学方程式_______,装置C的作用是_______。
和HCl,试写出D中发生反应的化学方程式_______,装置C的作用是_______。

(2)在E处石蕊试液由紫色变为红色,再变为五色,其原因是_______。
(3)若将E处烧杯中的溶液改为澄清石灰水,反应过程中的现象为_______。
(选填序号)
A.有白色沉淀生成 B.无明显现象 C.首先生成白色沉淀而后白色沉淀消失
(4)在选取试剂正确且适量前提下,反应开始后当关闭活塞K时,发现B的长颈漏斗中的液面上升不明显,你认为可能的原因是_______,证实该原因的操作方法是_______。
(5)把制得的足量![]() 通到
通到![]() 溶液时反应的离子方程式为_______。
溶液时反应的离子方程式为_______。
Ⅱ.若采用A、B,用![]() ,固体与体积比浓度为1:1的硫酸制取
,固体与体积比浓度为1:1的硫酸制取![]() 气体。
气体。
(1)此时,B中的液体一般应选用_______。
(2)用F或C代替B部分是否可行?若不可行,简要说明理由。_______。
Ⅲ.若将![]() 和
和![]() 分别通人滴有酚酞的NaOH溶液中,红色均褪去。请你设计一个实验,说明
分别通人滴有酚酞的NaOH溶液中,红色均褪去。请你设计一个实验,说明![]() 和
和![]() 使该溶液褪色的原理是不同的。
使该溶液褪色的原理是不同的。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
![]()

![]() 请回答下列问题
请回答下列问题
![]() (1) 实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是
(1) 实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是![]() ;装置中B瓶的作用是 。
;装置中B瓶的作用是 。
![]() (2)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是
(2)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是
![]() ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
![]() (3)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
(3)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 ![]() 。
。
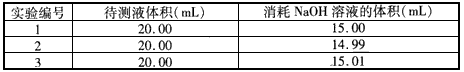
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol/L;实验后A中溶液:V=40mL c(H+)=1.0 mol/L。假设反应中HNO3既无挥发也无分解,则
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
(5)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
一、
题号
1
2
3
4
5
答案
A
D
C
B
C
二、
题号
6
7
8
9
10
11
12
13
14
15
16
17
答案
D
D
C
C
D
B
D
B
B
D
C
D
三、
题号
18
19
20
21
22
答案
C
AD
AC
C
BD
四、(本题共24分)
23、(每空1分,共8分)
(1)N , S
⑵ SiO2,SiO2是原子晶体,而CO2是分子晶体; H2O,水分子间作用力大于H2S分子间作用力; (3) Na2O2 (或FeS2;Na2SX等等,填写任意一个正确的即可);
(4) 
 24、(本题共8分)
24、(本题共8分)
(1) (方程式 1分,配平 1分,电子转移方向与数目 2分)
(2) SnCl2 , 3×6.02×1023 (每空1分,共2分) (3)1:1 (2分)
25、(本题共8分)
(1)放热 (1分)  (2)① 0.0175mol/L•min (1分) ②平衡(1分)
(2)① 0.0175mol/L•min (1分) ②平衡(1分)
③ 是 ,等于 ,
(每空1分,共3分) ④ a、b (2分)
五、(本题共24分)
26、(本题共12分)
(1)吸收空气中的CO2, 偏高 (每空1分,共2分)
(2)装置C反应前后质量 (1分)
(3),(5×c×v×10-3×84 )/ m1 (2分)
(4)NaHCO3(其他合理答案也可)(1分)(5)b (1分) (6)蒸发 (1分)
(7)烧杯、酒精灯 (每空1分,共2分) (8)偏高 (2分)
27、(本题共12分)
(1) 把装置中的空气赶走,防止NO被氧化为NO2 ,干燥反应中生成的气体 (每空1分,共2分) (2) 无色气体变为红棕色 ,热 (每空1分,共2分)
(3) 打开K1、K2持续通入一段时间的N2和O2 (2分)
(4)① 0.5 ②C中烧瓶在实验前后增加的质量 (每空2分,共4分)
(5)在A中加入过量含Cl-溶液,过滤后,将沉淀洗涤、干燥,最后称取沉淀的质量(2分)
(其他合理答案也可)
六、(本题共20分)
 28、(本题共8分)
28、(本题共8分)
(1)(各1分,共2分)
(2)(各1分,共2分)消去反应 酯化反应(或取代反应)
(3)(各2分,共4分)


29.(本题共12分)
(1)羟基 羧基
(各1分,共2分) (2分)
(2分)
 (2)HOCH2―CH2OH+O2
OHC―CHO+2H20 (2分) (3)B E (2分)
(2)HOCH2―CH2OH+O2
OHC―CHO+2H20 (2分) (3)B E (2分)
(4)(各2分,共4分) 
 (其他合理答案也可)
(其他合理答案也可)
七、(本题共16分)
30、(本题共6分)
(1)x=1 (2分)
(2)14.4 (2分)
(3)6 (2分)
31、(每空2分,共10分)
(1).2.8×105 ;18
(2).86.96%
(3). ;138
;138
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com