
题目列表(包括答案和解析)
(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2 、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2 、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:

(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2 、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2 、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:

根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
[化学—选修2:化学与技术](15分)
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下: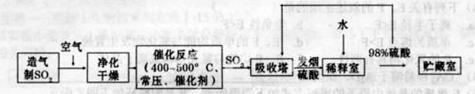

请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g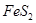 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量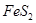 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有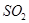 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中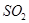 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中,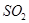 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、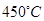 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择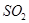 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。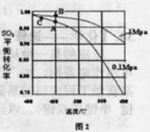
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 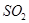 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):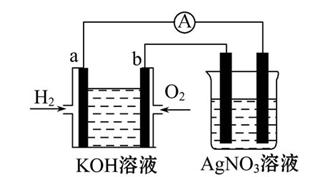
(1)对于氢氧燃料电池,下列表达不正确的是 。
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
1-5ABCBD
30.I。光照强度,温度,降低,降低
II.(2)用黑纸遮光,在适宜的温度条件下放置一段时间。(2分)观察水体变成淡黄色。(2分)
(3)把水体变黄的试管放在日光灯下,在适宜的温度条件下放置一段时间观察水体颜色变化,(2分)水体恢复成淡紫色。(2分)
分析预测的结果:
(1)遮光条件下,植物只能进行呼吸作用,随着水体中二氧化碳浓度的增加,pH值下降.水体变成淡黄色.由此验证植物的呼吸作用释放二氧化碳.(2分)
(2)光照条件下,植物的光合作用强于呼吸作用,随着水体中二氧化碳浓度的减少,pH值回升,水体又恢复成淡紫色.由此验证植物的光合作用吸收了二氧化碳。(2分)
(1)不放金鱼藻的水体(2分)
(2)温度、光强、金鱼藻数量(2分)
31.I (除注明外,每空1分,(1)红眼BbXaXa 2/3
(2)有丝分裂后 R或r
(3)①不可遗传变异
②实验步骤,第一步:用该未知基因型的黄色果蝇与正常黄色果蝇yy交配
第二步:将孵化出的幼虫放在不含银盐的饲养条件下培养,其他条件适宜
结果预测:如果后代出现了褐色果蝇,则所检测果蝇为“表型模拟”;如果子代全为黄色,说明所测黄色果蝇的基因型是yy,不是“表型模拟”2分
II. (1) 9(1分)4(1分) 黄色圆粒:黄色皱粒:绿色圆粒:绿色皱粒=9:3:3:1(1分)基因自由组合(1分)
(2)、(3)各3分:图解2分,说明1分


(4)YyRrDd,YyrrDd(2分)
化学参考答案和评分意见
6B 7D
26.(15分)
(1)H 氧 (各2分,共4分)
(2) 或
或
 (或其它合理答案) (各2分,共4分)
(或其它合理答案) (各2分,共4分)
(3) (3分)
(3分)
(4) (2分)
(2分)
(5) (2分)
(2分)
27. (13分)(1) 的电子式 (2分)
的电子式 (2分)
(2)① (2分)
(2分)
② (3分)
(3分)
(3) ;(3分)
;(3分)
 (3分)
(3分)
28(16分)(1)泥三角 干燥器(2分)
(2)C(2分)
(3)3CuSO4===3CuO+2SO2↑+SO3↑+O2↑(2分)
B装置的作用是吸收SO3 (2分) D装置的作用是除去SO2 (2分)
等到冷却后方可读数(2分)
O3 (2分)将褪色后溶液加热如恢复红色为SO2,如不恢复则为臭氧。(2分)
 29(16分)(1)C9H10O3(2分) A的一种可能结构为(2分)
29(16分)(1)C9H10O3(2分) A的一种可能结构为(2分)
羧基、羟基(2分)
 物理参考答案和评分意见
物理参考答案和评分意见
14.AD 15.A 16.A 17.B 18.BD 19.A 20.C21.AD
22. (17分) (1) 102.35,10.296;(2) (2)①C,②CD; (3) ①较大,②30
23. (16分) 解:(1)设力F作用时物体的加速度为a1,对物体进行受力分析,由牛顿第二定律可知 F-mgsinθ-μmgcosθ=ma1 (1分)
撤去力后,由牛顿第二定律有 mgsinθ+μmgcosθ=ma2 (1分)
由图可知:a1=
t1=1s时物体的速度:v1=a1t1 (1分)
拉力F的平均功率为P=Fv1/2 (1分)
解得P=300W (1分)
(2)设撤去力后物体运动到最高点时间为t2, v1=a2t2,解得t2=2s (2分)
则物体沿着斜面下滑的时间为t3=t-t1-t2=1s
设下滑加速度为a3,由牛顿第二定律 mgsinθ-μmgcosθ=ma3,a3=
t=4s时速度v=a3 t3=
24.(1)根据能量守恒:

(2)此时圆形金属圈切割磁场的有效长度L= m―(2分)
m―(2分)
 V ---(2分)
V ---(2分)
 V ---(4分)
V ---(4分)
(3)
 ------(2分)
------(2分)

 ------(3分) 方向向左 --------(1分)
------(3分) 方向向左 --------(1分)
 25. 解:(1)(6分)
25. 解:(1)(6分)
如上图,设粒子刚进入第一个有电场和磁场分布的区域时速度为v,由于qE=mg,所以粒子在里面作匀速圆周运动,设出第一个区域时与水平方向夹角为θ,则:
 vx=vcosθ 又
vx=vcosθ 又 即
即 代入得 vx=
代入得 vx= =
= =
=
(2)(7分)设粒子进入任意一个有电场和磁场分布的区域时速度为v,粒子作匀速圆周运动,设进入区域时与水平方向夹角为α,出区域时与水平方向夹角为β,则:
 ; 又
; 又
得
 =
= =
=
(3)(7分)设刚好能从第n个有磁场和电场的区域内射出(或不射出)
由能量关系有

在最低点,速度水平,即
 则
则 

故粒子不能穿过第61个有电场和磁场的区域
注意:此题也可以用微元的思想

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com