
题目列表(包括答案和解析)

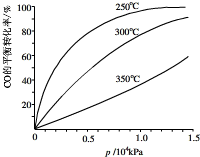 (2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 | △ |
 (1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=| 8 |
| 3 |
| 8 |
| 3 |
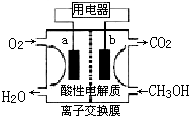 减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求.
减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求.
| ||
| 加压 |
| ||
| 加压 |
| 3 |
| 2 |
| 3 |
| 2 |
| 8 |
| 3 |
| 8 |
| 3 |
| ||
| ||
| ||
| ||
| ||
1
2
3
4
5
6
7
8
9
10
C
B
B
C
B
D
A
D
B
D
11
12
13
14
15
16
17
18
19
20
B
B
B
D
A
C
A
C
B
B
21、在下列空白处说明反应条件的改变对化学平衡的影响。
条件的改变
对化学平衡的影响
增大反应物的浓度
正向移动
增大容器中气体的压强
向体积减小方向移动
升高温度
向升高温度方向移动
适当使用催化剂
不移动
22、0.3mol/(L?S)
23、加深 逆向移动 不移动
24、逐渐减小 逐渐增大 相等
25、酸性 碱性 中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com