
题目列表(包括答案和解析)
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.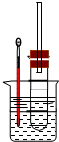 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.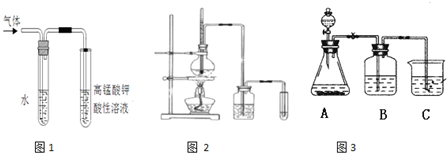
| 醇 |
| 加热 |
| 醇 |
| 加热 |
| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |
| ||
| ||
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
| ||
| △ |
| ||
| △ |
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.一.选择题(60分)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
A
C
C
A
C
B
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
B
D
B
B
C
D
C
B
二.填空题(34分)
21.(1) 碳碳双键 氯原子 (2) 4-甲基-3-乙基辛烷
(3) 
22、  。
。
23.(1) 4 (2)_
(CH3)
24、(1) 4 。 (2) 0 个。 (3) ⑤
25.(1) 有气泡生成(1分) , 酸性高锰酸钾溶液褪色(1分) ;
(2) 除去乙烯中的乙醇,排除干扰(2分) ;
(3)  (2分); 消去反应(1分) 。
(2分); 消去反应(1分) 。
(4) D (1分)
 26、(1) 2 5
。 (2)方程式 3 H2N―C≡N
26、(1) 2 5
。 (2)方程式 3 H2N―C≡N
 ,
,
三聚氰胺的含氮量高为66.7%(1分),可提高奶粉的含氮量,冒充蛋白质(1分)
三、计算题(6分)
27、解:(1)2.3gA中含H物质的量为: =0.3mol
(1分)
=0.3mol
(1分)
由质量守恒定律可知:m有机物 + mO2 = m(CO2) + m(CO) + m(H2O)
 ×
×
2.3gA中含C物质的量为 +
+ = 0.1mol (1分)
= 0.1mol (1分)
(2) =0.05mol (1分)
=0.05mol (1分)
该有机物中C、H、O原子个数比为:2:6:1 化学式为:C2H6O (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com