
题目列表(包括答案和解析)
0℃,1.01×105Pa时,分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,
| 反应容器 | 甲 | 乙 | 丙 | |
| 加入合金质量(g) | 0.510 | 1.53 | 3.57 | |
| 与盐酸反应生成气体(L) | 0.560 | 0.672 | 0.672 | |
| 与氢氧化钠反应产生气体(L) | 0.336 | x | y |
再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若在甲、乙、丙三个容器中加入与盐酸同体积同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积,如下表:
根据表中数据可以计算得出的是_________;
A.合金的组成 B.合金中组分的含量
C.盐酸的物质的量浓度 D.盐酸的密度
能计算出的量的值为__________________;
(2)若两种金属是下列选项中的某两种,则从甲容器中的两次实验:
①不经计算,肯定没有________________(填字母符号);
A.40Ca B.56Fe C.64Cu D.24Mg E.27Al
②通过计算讨论推测合金的成分____________;
(3)根据(2)的推测结果,计算x和y的值分别为多少?
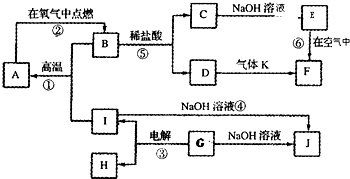
 A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).




1---5 DADDA 6---10 ACCDC 11---15 CDCDA 16---17 BD
18. (1)4 ⅢA (每个1分,共2分) (2)3d24s2(2分)
(3)1s22s22p63s23p63d64s2(2分) (4)Si S (4分)
(5)铬 (2分)
19.(1)OH-、Mg2+、H2O(3分)
(2)极性,< ,A B D(每个1分,共5分)
(3)三角锥形 V形(4分),
(4)HF(2分)
20. A D (每个2分,共4分)
同一族中3、4、5周期气态氢化物的分子结构相似,相对分子质量依次增大,范德华力依次增大,所以沸点依次升高。(3分)
A、B、C曲线中第2周期元素的气态氢化物分别是H2O、HF、NH3,氢化物分子间存在氢键,沸点升高,所以比第3周期对应氢化物的沸点高(3分)
21. ⑴ 右表中
 (2分)
(2分)
⑵IVA (1分) H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H(其他合理答案如与碱金属元素形成离子化合物NaH也可)(2分)
⑶3s2 3s23p1 ` > < > (每个1分,共5分)

⑷ (2分)
22. △H=D(H-H)+D(Cl-Cl)-2 D(H-Cl)
∴ D(H-Cl)=(436+247+185)/2=434 kJ?mol-1 (6分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com