
题目列表(包括答案和解析)
A、B、C、D、E为5种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
微粒 代码 | A | B | C | D | E |
原子 核数 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 1― | 0 | 2+ | 1+ | 0 |
其中:B是由极性键构成的4原子分子,A和D可以形成B和E。
(1)A、C、E的化学式是:A C E 。
(2)室温下,等物质的量的B与盐酸反应后,溶液pH 7(填“<”“>”或“=”),反应后溶液质中质中存在 。
A.离子键 B.极性键 C.非极性键 D.配位键
(3)已知B和E分子中存在着氢键,请写出另一种同样含有氢键的微粒,而且要求该外共含有10电子: 。
 2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=





1---5 DADDA 6---10 ACCDC 11---15 CDCDA 16---17 BD
18. (1)4 ⅢA (每个1分,共2分) (2)3d24s2(2分)
(3)1s22s22p63s23p63d64s2(2分) (4)Si S (4分)
(5)铬 (2分)
19.(1)OH-、Mg2+、H2O(3分)
(2)极性,< ,A B D(每个1分,共5分)
(3)三角锥形 V形(4分),
(4)HF(2分)
20. A D (每个2分,共4分)
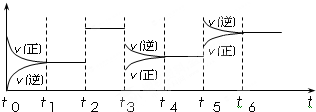
同一族中3、4、5周期气态氢化物的分子结构相似,相对分子质量依次增大,范德华力依次增大,所以沸点依次升高。(3分)
A、B、C曲线中第2周期元素的气态氢化物分别是H2O、HF、NH3,氢化物分子间存在氢键,沸点升高,所以比第3周期对应氢化物的沸点高(3分)
21. ⑴ 右表中
 (2分)
(2分)
⑵IVA (1分) H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H(其他合理答案如与碱金属元素形成离子化合物NaH也可)(2分)
⑶3s2 3s23p1 ` > < > (每个1分,共5分)

⑷ (2分)
22. △H=D(H-H)+D(Cl-Cl)-2 D(H-Cl)
∴ D(H-Cl)=(436+247+185)/2=434 kJ?mol-1 (6分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com