具有还原性的无水草酸是无色无臭的透明结晶或白色粉末.草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳.
(1)草酸(H
2C
2O
4)分解的化学方程式为:
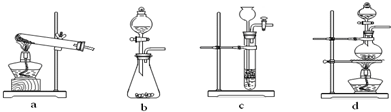
,下列装置中,可用于草酸分解制取气体的是
.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe
2O
3?nH
2O
和Fe两种成份),实验装置如下图所示,请回答:
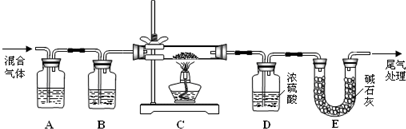
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是
、
.
②在点燃酒精灯之前应进行的操作是:(a)
;(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
(假定Fe和H
2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是
(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe
2O
3 d.反应后固体是铁和少量Fe
2O
3?nH
2O
(3)该探究小组还利用KMnO
4酸性溶液与H
2C
2O
4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
(每次实验KMnO
4酸性溶液的用量均为4mL、H
2C
2O
4溶液的用量均为2mL,催化剂
实验
编号 |
实验目的 |
T/K |
催化剂用量/g |
C/mol?l-1 |
| KMnO4 |
H2C2O4 |
| ① |
为以下实验作参考 |
298 |
0.5 |
0.01 |
0.1 |
| ② |
探究KMnO4酸性溶液的浓度对该反应速率的影响 |
298 |
0.5 |
0.001 |
0.1 |
| ③ |
|
323 |
0.5 |
0.01 |
0.1 |
| ④ |
探究催化剂对反应速率的影响 |
|
|
|
0.1 |
的用量可选择0.5g、0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案
.

 金属和非金属与人类生活、生产密不可分.
金属和非金属与人类生活、生产密不可分. 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 

