
题目列表(包括答案和解析)
(12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)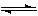 CH3OH(g)
ΔH =-a
kJ·mol-1
CH3OH(g)
ΔH =-a
kJ·mol-1
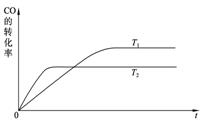
(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
① a __0(填“>” “<” “=”)。
② 下列说法正确的是_ _(填序号)。
a.1 mol CO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.将1 mol CO(g) 和2 mol H2(g) 置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g) 和H2(g) 置于某密闭容器中充分反应后放热a KJ,则此过程中有1 mol CO(g) 被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示:
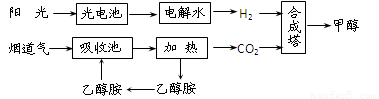
① 该合成路线对于环境保护的价值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_ _。
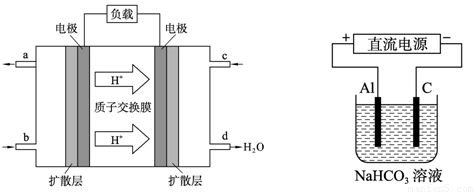
(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_ 。
(8分)沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭,还可以设计成燃料电池。
![]() (1)利用沼气设计成燃料电池可实现如下能量转化:(在框内填写能量的形式)
(1)利用沼气设计成燃料电池可实现如下能量转化:(在框内填写能量的形式)
(2)在101kPa时,16gCH4燃烧生成CO2和液态H2O,放出890kJ的热量,写出甲烷燃烧的热化学方程式为______________ _______________。
(3)120℃,取CH4和过量O2的混合气体共0.4mol,点燃使其充分反应并恢复到原状态,将燃烧后的气体通过过量的碱石灰(NaOH和CaO的固体混合物)充分吸收,碱石灰增重8g。
计算:①原混合气体中CH4和O2的体积比是
②碱石灰吸收后剩余气体在标准状况下的体积为 。

安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善。已知SO2可以用Fe( NO3)3溶液吸收, 0.1mol/L的Fe(NO3)3溶液的pH=2。某学习小组据此展开如下相关探究:
【探究I】铜与浓硫酸的反应探究:
(l)取12.8g铜片于三颈烧瓶中,通N2一段时间后再加入20 mL 18 mol?L-1的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀,充分反应后,烧瓶中仍有铜片剩余。
①该小组同学认为烧瓶中除有铜片剩余外还应有较多的硫酸剩余,其原因是: ___________________ 。
②该小组同学欲通过测定产生气体的量来求余酸的物质的量,设计了多种实验方案。下列方案不可行的是______ 。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量硫酸酸化的高锰酸钾溶液后,再加入足量的BaCl2溶液,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
【探究II】装置B中产生沉淀的原因探究:
(2)加入浓硫酸之前先通N2一段时间,其目的是____ 。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列猜想(不考虑各因素的叠加):
猜想1: 装置A中的白雾进入B参与反应
猜想2:SO2被Fe3+氧化为SO42-
猜想3: 。
(4)甲同学认为只要在装置A、B间增加洗气瓶C,就可以排除装置A中白雾影响,则C中盛放的试剂是 。
(5)乙同学取出少量装置B中清液,加入几滴酸性高锰酸钾,发现紫红色褪去,据此认为猜想2成立。你是否同意其结论?并说明理由: 。
【思考与交流】
(6)实验结束后,若使烧瓶中铜片继续溶解,下列方案(必要时可加热)可行的是 。
A.打开弹簧夹,通入O2 B.由分液漏斗加入H2O2溶液
C.由分液漏斗加入NaNO3溶液 D.由分液漏斗加入Na2SO4溶液
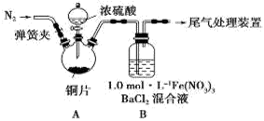
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com