
题目列表(包括答案和解析)
 xC(g)
xC(g) N2O4(g) ΔH<0。
N2O4(g) ΔH<0。 CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
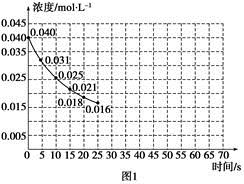
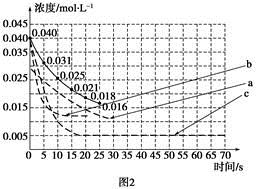
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |

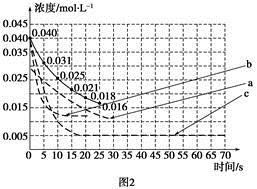
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com