(1)80℃时,将0.40mol的N
2O
4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N
2O
4?2NO
2△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
n(mol) | | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算20s~40s内用N
2O
4表示的平均反应速率为______ mol/
②计算在80℃时该反应的平衡常数K=______;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)______;
④要增大该反应的K值,可采取的措施有(填序号)______
A.增大N
2O
4的起始浓度B.向混合气体中通入NO
2 C.使用高效催化剂 D.升高温度
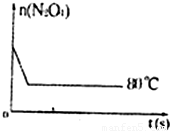
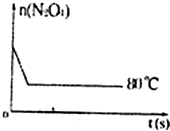
⑤如图是80℃时容器中N
2O
4物质的量的变化曲线,请在该图中补画出该反应在60℃时N
2O
4物质的量的变化曲线______.
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(K
sp).例如Cu(OH)
2(S)?Cu
2+(aq)+2OH
-(aq),K
sp=c(Cu
2+)?[c(OH
-)]
2=2×10
-20当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO
4溶液里c(Cu
2+)=0.02mol/L,如果生成Cu(OH)
2沉淀,应调整溶液pH,使之大于______;
要使0.2mol/L的CuSO
4溶液中Cu
2+沉淀较为完全(使Cu
2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______.
(3)常温下,某纯碱(Na
2CO
3)溶液中滴入酚酞,溶液呈红色.则该溶液呈______性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na
2CO
3电离出的CO
32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
______.