
题目列表(包括答案和解析)
 A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).
A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).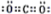
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 +CuCl2
② Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Zn + CuSO4 = ZnSO4+ Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe) ;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu) ; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com