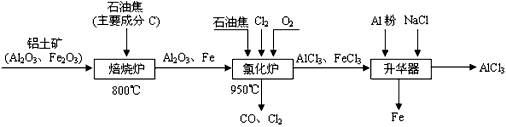
(1)已知:
C(s)+1/2O
2(g)==CO(g) △H=-110.5kJ/mol
2Fe(s)+3/2O
2(g)===Fe
2O
3(s) △H=-822.1kJ/mol
请写出C还原Fe
2O
3生成CO的热化学方程式___________________________。
(2)反应2CO+O
2
2CO
2的平衡常数为K1;反应4Fe+3O
2
2Fe
2O
3的平衡常数K2,则反应
3CO+Fe
2O
3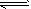
2Fe+3CO
2的平衡常数K与K1、K2的关系式___________。
(3)高温下,氧化铁能跟碳发生下列反应:
① Fe
2O
3+3C

2Fe+3CO ② Fe
2O
3+3CO

2Fe+3CO
2 若反应产生的气体是CO
2和CO,则
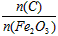
的取值范围是_________________。
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因____________________。
(5)氯化炉中发生:3Cl
2(g)+3C(s)+Al
2O
3(s)
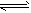
2AlCl
3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
①增加C的量 ②多通入Cl
2 ③升高温度 ④移走部分AlCl
3(g)
⑤使用合适的催化剂工业上还常采用向氯化炉中通入O
2的方法,其目的是________________。
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10
-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl
3和FeCl
3的混合溶液中逐滴加入氨水,当Fe
3+完全沉淀时,测定c(Al
3+)=0.2mol/L。此时所得沉淀中_____(填“是”或“否”)含有Al(OH)
3。(已知:Ksp[Fe(OH)
3]=4.0×10
-38,Ksp[Al(OH)
3]=1.1×10
-33)。

 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应
2Fe2O3的平衡常数K2,则反应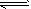 2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
2Fe+3CO2的平衡常数K与K1、K2的关系式___________。 2Fe+3CO ② Fe2O3+3CO
2Fe+3CO ② Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2 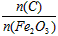 的取值范围是_________________。
的取值范围是_________________。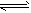 2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):