
题目列表(包括答案和解析)
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10ˉ6 | 6x 10ˉ6 | 2x10ˉ5 | 4x10ˉ5 | 3x10ˉ5 | 2x10ˉ5 |
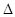 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) 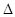 H= -110.5KJ/mol
H= -110.5KJ/mol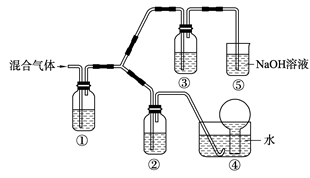
对电动汽车和燃油汽车的比较
当前,因汽车造成的环境污染日益严重,而电动汽车却有许多优点:无污染;运行经济,每千米成本大约是汽油车辆的1/2;开起来平稳、安静、安全;维修费用低;冬天容易启动和停止。尽管有这么多的优点,目前电动汽车却难以大规模发展,其中的关键问题是什么?可能的解决方向在哪里?看过下文,你会有所了解。
(1)效率
在任何车辆中,能源所储存的能量决不会完全转化为动能,能量的一部分总是作为热消耗掉了,百分效率就给出了储存的能量转化为动能的百分比。下图为二者的能量转换百分比。
![]()
(2)能量密度
储存电需要蓄电池,储存汽油需要油箱,所谓能量密度,就是每千克储能物质所储存的能量。下图是汽油和普通汽车用蓄电池的对比。
![]()
(3)行程
车辆每充一次电或装满一箱汽油能够行驶的距离叫做它的行程。
谁都希望加一次油或充一次电行驶的距离越远越好,行程决定了车辆使用是否方便。一般情况下,电动汽车充一次电能行驶80 km,而汽车加满一次油能行驶240 km左右。
![]()
(4)充电
电动车辆里的蓄电池,每天夜里都需要充电,给它们充电由通常的电源提供,电来自发电站,所以对于蓄电池来说,实际是由发电站提供的能量。
一个12 A的插座,能够提供3 kW的电能,即3 kJ·s-1,而汽车加油站每秒能灌到油箱里1 kg汽油,其储存的能量近3×104 kJ,所以汽车加油比电池充电的速度快1万倍。为了提供和汽车加油一样快的充电速度,要用40 cm粗的电缆线才行。
思考:通过阅读本文,你认为电动汽车和燃油汽车相比,有哪些优缺点?电动汽车目前难以发展的制约点是什么?
世界八大公害事件中的洛杉矶光化学烟雾事件的罪魁祸首之一就是氮的氧化物.
光化学烟雾的形成过程是很复杂的,通过实验室模拟研究,已经初步弄清了它们的基本化学过程.大体上为:
①被污染空气中的二氧化氮的光分解.
②在被污染的空气中同时存在着许多有机物,它们跟空气中的O2、O3、NO2起反应,氧化成一系列有机物,生成烟雾.
③氧化过程中的中间产物导致一氧化氮向二氧化氮转化,并导致有毒产物的产生.
光化学烟雾一般发生在大气相对湿度较低、气温为24-32℃的夏季晴天,污染的高峰出现在中午或稍后.可能由于日光照射情况不同,光化学烟雾除显淡蓝色外,有时带紫色,有时带褐色.光化学烟雾能在空气中远距离传输.
1998年的诺贝尔生理学或医学奖由三位科学家分享,他们首次发现了一氧化氮是心血管系统中传播信号的分子,在神经信号传递、血压生理调控、血液流量控制、免疫调节和抵抗感染等许多方面均起重要的作用.
人们确知,生物体内许多组织都会释放出一氧化氮,而且其浓度的变化与机体的生理机能密切相关.许多现代病、多发病,如心脑血管病、血凝失常、高血压、中风、糖尿病、老年性痴呆、免疫功能损伤甚至癌症、毒瘾以及记忆和学习障碍等都与一氧化氮有关.这些疾病都可能是由于生物体内一氧化氮的释放与调节不正常引起的.
问题:NO这种大气污染物竟然在生命过程中有着如此重要的作用,这给予我们什么启示呢?
材料一:酸雨是英国化学家R.A.Smith 1872年最先提出的,一般是指pH小于5.6的雨、雪、雾等大气降水,是大气污染的表现。酸雨被称作“空中死神”。据某市区1998年环境状况公报载,市区酸雨频率为41.3%,比上年上升了5.5个百分点。降水的年平均pH为4.87,降水酸性污染较严重,表现为煤烟型污染特征。
材料二:①某地一场较大范围的酸雨使植物叶面遭到腐蚀,产生大量斑点而坏死,导致西瓜大面积绝产,损失惨重。②酸雨使植物阳离子从叶面析出,使钙、镁、铁等离子迅速从土壤中损失,土壤营养状况降低,还使光合作用受到抑制,影响植物的生长。③铝对生物来说是有害元素,在土壤中以氧化铝形式存在,pH=5.6时几乎不溶解。当pH为4.6时,铝的溶解度增加100倍,并转化成硫酸铝,造成树木死亡。四川某林场,华山松死亡率达96%,就是酸雨使土壤中硫酸铝浓度增高,危及华山松。
材料三:我国农业生产因遭受酸雨造成的损失每年高达15亿元。为了有效控制酸雨,国务院已经批准了《酸雨控制区和二氧化硫控制区划分方案》等规定。
某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水作水样进行测定,随时间的推移,多次测定该样品的pH,得到如下数据:
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)问题:①雨水样品放置时pH变化的主要原因(用化学方程式表示)_____________________;由此可以得出酸雨的形成过程可能是______________________________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将_________________ (填“增大”“减小”或“不变”),原因是__________________________________;二氧化硫表现_____________性。
(2)列举酸雨给人类造成的危害。
(3)你认为减少酸雨产生的途径可采取的下列措施是__________________________________。
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①③ B.②③④⑤ C.①③⑤ D.①③④⑤
(4)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用Ca(OH)2的悬浊液吸收煤燃烧时产生的二氧化硫气体,并回收制得有用的石膏(CaSO4·2H2O),则有关反应的化学方程式_____________________,__________________,___________________。
②硫酸工业常用浓氨水来吸收二氧化硫,则有关的化学方程式为_____________________。
③有些工业采取将生石灰和含硫煤混合使用。请写出燃烧时有关“固硫”反应的化学方程式。__________________________________________
④国际上最新采用“饱和亚硫酸钠溶液吸收SO2法”。请写出有关反应的化学方程式。_____________________
⑤请比较以上四种“固硫”方法的优缺点。_____________________
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com